微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 将??NO3-+Zn+OH-+H2O→NH3+Zn(OH)42-??配平后,离子方程式中H2O的系数是( )
A.2
B.4
C.6
D.8
参考答案:在NO3-+Zn+OH-+H2O→NH3+Zn(OH)42-
本题解析:
本题难度:一般
2、填空题 将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:___KMnO4+___HCl →___KCl+___MnCl2+___Cl2↑+___H2O
(2)上式反应中的还原剂是_______,当还原剂失去1mol电子时,氧化产物的物质的量为_______mol。
(3)a+b的最大值为_________,a+b最小值为_________。
(4)当a+b =0.18时,残留固体的质量为_________g。
参考答案:(1)2、16、2、2、5、8
(2)HCl;0.5
本题解析:
本题难度:一般
3、选择题 有Fe2+、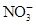 、Fe3+、
、Fe3+、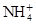 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(?? )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(?? )
A.氧化剂与还原剂的物质的量之比为8∶1
B.还原产物为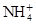
C.若有1 mol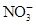 参加还原反应,转移8 mol e-
参加还原反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
参考答案:A
本题解析:分析各粒子的性质判断反应物和生成物,反应物应为Fe2+、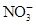 和H+,生成物应为Fe3+、
和H+,生成物应为Fe3+、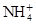 和H2O。运用得失电子守恒,配
和H2O。运用得失电子守恒,配
本题难度:一般
4、填空题 北京市场销售的某种食用精制盐包装袋上有如下说明

(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于横线上)?___?KIO3+____KI+____H2SO4=___K2SO4+____I2+____H2O ????
(2)上述反应生成的I2可用四氯化碳溶液检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。 ????
①Na2SO3稀溶液与I2反应的离子方程式是_____________________。 ????
②某学生设计回收四氯化碳的操作步骤为: ????
a.将碘的四氯化碳溶液置于分液漏斗中;???? ????
b.加入适量Na2SO3稀溶液; ????
c.分离出下层液体。 ????
以上设计中遗漏的操作及在上述步骤中的位置是___________________。 ????
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:???? ????
a.准确称取wg食盐,加适量蒸馏水使其完全溶解; ????
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全; ????
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3?mol/L的Na2S2O3溶液10.0?mL,恰好反应完全。 ????
①判断c中反应恰好完全依据的现象是____。 ????
②b中反应所产生的I2的物质的量是____mol。 ????
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________
mg/kg。
参考答案:(1)1?5?3?3?3?3
(2)①I2?+SO3
本题解析:
本题难度:一般
5、填空题 (4分)配平氧化还原反应方程式。
(1) NH3+ NO2— N2+ H2O
(2) 氧化产物与还原产物的质量比为 。
参考答案:(4分)(1)8 6 14 12 &#
本题解析:本题考查氧化还原反应方程式的配平
(1)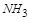 中
中 ,
,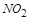 中
中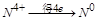 ,得失电子数的最小公倍数为
,得失电子数的最小公倍数为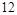 ,
,
在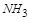 前配系数
前配系数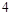 ,在
,在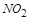 前配系数3,则
前配系数3,则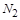 前配系数为
前配系数为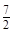 ,再配平
,再配平 ,在
,在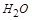 前配
前配 ;
;
即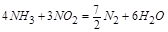
此方程式的两端同乘以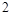 得
得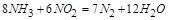
(2) 在反应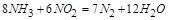 中,
中,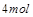
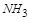 被氧化成
被氧化成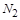 ,
,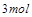
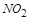 被还原
被还原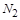 ,产物均为
,产物均为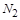 ,因而氧化产物与还原产物的质量比为
,因而氧化产物与还原产物的质量比为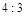 .
.
本题难度:一般