微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中不正确的是
A.静电除尘治理悬浮颗粒物污染,其依据是胶体的电泳原理
B.“候氏制碱法中”,在饱和的NaCl溶液中先通入NH3,再通入CO2
C.水的离子积常数随温度的升高而增大,60℃时0.01mol/LNaOH 溶液PH=12
D.叠氮酸与醋酸的酸性相似,在NaN3的水溶液中存在离子浓度:c(Na+)> c(N3-)> c(OH-)> c(H+)
2、选择题 常温下将浓度均为0.1 mol / L的CH3COOH和CH3COONa两溶液等体积混合,混合溶液的pH<7,有关叙述正确的是(??)
A.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.向混合后的溶液中滴入NaOH溶液至pH=7,则有c(Na+)=c(CH3COO—)
D.混合溶液加水稀释,c(OH— )减小
3、填空题 某地有软锰矿和闪锌矿两座矿山,它们的组成如下: 软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分; 闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。 科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
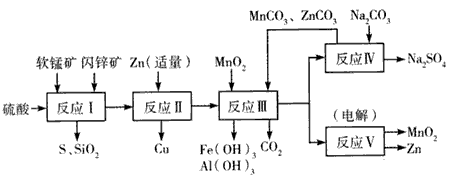
请回答下列问题:
(1)反应I的滤液中含有MnSO4 、ZnSO4、CuSO4 、Fe2(SO4)3、Al2(SO4)3等。试完成反应I中生成CuSO4和MnSO4的化学方程式:MnO2+CuS+___=___↓+MnSO4+CuSO4+___。
(2)反应Ⅱ加入适量锌的作用是___, 如果锌过量,还会进一步与___等离子反应。
(3)反应Ⅲ要调节pH生成Fe(OH)3、Al(OH)3,中和过量的H+所使用的物质是___,调节的pH 范围是___(pH数据见下表)。
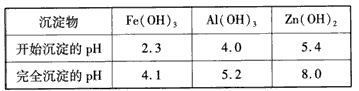
(4)本工艺可以循环利用的物质除MnCO3、ZnCO3以外,还有____。
4、填空题 (9分)已知25℃时,CH3COOH和NH3·H2O的电离平衡常数分别为Ka(CH3COOH)=l.7×10-5mol/L,Kb(NH3·H2O)=1.7×l0-5mol/L。现有常温下1 mol/L的醋酸溶液和l mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
(1)醋酸溶液中存在的电离平衡用电离方程式表示为???????,
(2)将上述两种溶液等体积混合,所得溶液的pH=???????。
(3)饱和氯化铵溶液显酸性,原因是(用离子方程式表示)???????;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解。甲、乙两位同学分别提出了不同的解释:
甲同学:由于NH4+水解呈酸性,其H+结合Mg(OH)2电离的OH-,使Mg(OH)2溶解
乙同学:由于Mg(OH)2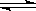 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH-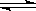 NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释??????????。
NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释??????????。
5、选择题 在常温下,将PH=11的某碱溶液和PH=3的某酸溶液等体积混合后,下列说法正确的是(??? )
A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐
B.若所得溶液呈碱性,则可能是强碱与弱酸溶液反应
C.若所得溶液呈酸性,则可能是强酸与弱碱溶液反应
D.若所得溶液的PH=5,则可能是强碱与弱酸溶液反应