微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。
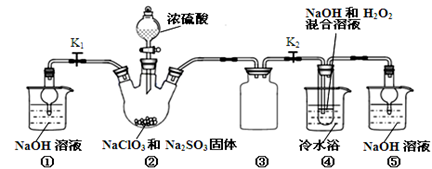
完成下列填空:
(1)装置②中产生ClO2的化学方程式为???????????。装置③的作用是?????????????。
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②??????????;③???????;④低于60℃干燥,得到成品。
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+ 4I-+4H+ →2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。配制待测液需用到的定量玻璃仪器是????????????;
(4)取25.00mL待测液,用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为??????????。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为?????????????。
(5)通过分析说明装置①在本实验中的作用???????????????????????????????。
参考答案:(1)2NaClO3 + Na2SO3 + H2SO4→2C
本题解析:
试题分析:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为2NaClO3 + Na2SO3 + H2SO4=2ClO2 + 2Na2SO4 + H2O;装置③为安全瓶,防止装置②中气体温度降低而产生倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(3)容量瓶要指明规格;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2-——2I2——4S2O32-
n(ClO2-)= 1/4 n(S2O32-)=1/4×20×10-3×2=0.01mol
m(NaClO2)=0.01×90.5=9.05g????该样品中NaClO2的质量分数为9.05g÷10g=0.905
(5)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气。
本题难度:一般
2、填空题 现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
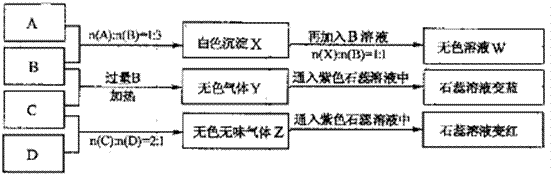
请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为???????、???????。
(2)D溶液pH??(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)??????????。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是????????????????????????????????????
?????????????????????????????????????????????????。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4):前者????后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是??????????????????????????????????????????????????????????????
参考答案:
(16分) (1)Al2O3 、 NaAlO2???
本题解析:略
本题难度:简单
3、选择题 为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
序号
| 物质
| 杂质
| 除杂质应选用的试剂或操作方法
|
①
| KNO3溶液
| KOH
| 滴入稀HNO3同时用pH试纸测定至溶液呈中性
|
②
| FeSO4溶液
| CuSO4
| 加入过量铁粉充分反应并过滤
|
③
| H2
| CO2
| 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
|
④
| BaSO4
| BaCO3
| 加盐酸溶解、过滤、洗涤、干燥
?
A.①②③?????B.②③④???? C.①③④????D.①②③④
参考答案:D
本题解析:
试题分析:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则,据此可以解答。①氢氧化钾与硝酸恰好反应时生成硝酸钾和水,溶液呈中性,①正确;②铁与硫酸铜反应生成硫酸亚铁和铜,过滤除去铜和过量的铁即可,②正确;③CO2被氢氧化钠溶液吸收,然后通过浓硫酸干燥氢气即可,③正确;④碳酸钙溶于盐酸,硫酸钡不溶,过滤干燥即得到硫酸钡,④正确,因此答案选D。
本题难度:一般
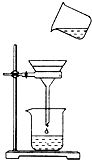
4、简答题 已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl═AgCl↓+KNO3.将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是______.
(2)向溶液中加入适量的______溶液,使Cl-转化为沉淀.
(3)混合液进行过滤,过滤装置和操作如图,指出右图中的两处错误:①______;②______.
(4)为了从滤液中得到硝酸钾晶体,可选用的两种结晶方法是:①______;②______.
参考答案:(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,
本题解析:
本题难度:简单
5、选择题 为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.②⑤④①③
B.④①②⑤③
C.④②⑤①③
D.①④②⑤③
参考答案:A
本题解析:
试题分析:Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此正确的顺序可以是②⑤④①③,答案选A。
本题难度:一般
|