微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物已略去)。
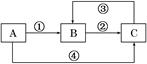
(1)若A是一种两性氧化物,B的水溶液呈酸性,请写出反应①和反应④(由A一步转化为B或C)的离子方程式:反应①______________________________________;
反应④_______________________________________________________。
(2)若反应①为置换反应,反应④为化合反应,C物质大量存在于海水中,是人体生理活动不可缺少的物质。工业上可以用C来制取A或B,请写出这两个反应的化学方程式:C→A________________________________________________________________________;
C→B_______________________________________________________________;
(3)若反应①②③均为化合反应,反应④为置换反应。当A为一种金属单质时,请写出反应②和③可能的离子方程式:②_____________________________________________;
③_____________________________________________________________________。
参考答案:(1)Al2O3+6H+=2Al3++3H2O??? Al2
本题解析:(1)高中阶段具有两性的氧化物代表为Al2O3,Al2O3与H+反应生成Al3+和H2O(反应①),Al2O3与OH-反应生成AlO2-和H2O(反应④),AlO2-与过量的H+反应生成Al3+和H2O(反应③),Al3+与过量的OH-反应生成AlO2-和H2O(反应②)。
(2)首先确定C为NaCl,电解熔融态NaCl生成Na、Cl2,电解饱和NaCl溶液生成NaOH、H2、Cl2,故A为Na,B为NaOH。
(3)金属元素中,铁的价态变化复杂,所以首先联想A为Fe,Fe可与盐酸反应生成Fe
本题难度:一般
2、填空题 (9分)取少量Fe2O3粉末(红褐色)加入适量盐酸,发生的化学反应方程式为:
???????????????????????????????????????
得到棕黄色的FeCl3溶液,用此溶液分别做如下实验。
①取少量FeCl3溶液于试管,滴入几滴NaOH溶液,生成红褐色沉淀,发生的离子反应方程式为?????????????????????????????????????????????????????????????
②在小烧杯中加入20mL蒸馏水,煮沸后,滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,即制得______。用激光笔照射烧杯中的液体,可以观察到液体中?????????????????????????????。这个实验可用于区别?????????????????。
③取少量FeCl3溶液,加入过量铁粉,溶液由棕黄色变成浅绿色,经检验生成了FeCl2。写出反应的离子方程式:??????????????????????????????????????????
参考答案:Fe2O3+6HCl=2FeCl3+3H2O
① Fe
本题解析:略
本题难度:简单
3、填空题 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
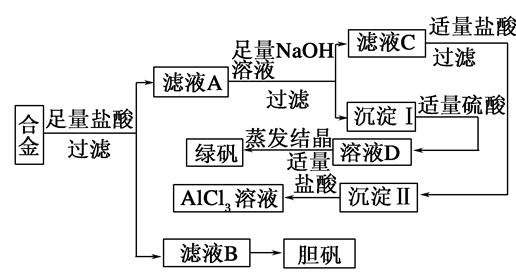
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理”?或“不合理”),理由是__________。
参考答案:(1)烧杯、漏斗、玻璃棒
(2)反应过程中部分二价铁转
本题解析:(1)过滤属于基本操作,玻璃仪器有烧杯、漏斗、玻璃棒。
(2)Fe2+很容易被空气中的氧气氧化为Fe3+,加入足量铁粉于溶液中,就可以使Fe3+转化为Fe2+,从而使滤液蒸发结晶即可得绿矾。
(3)稀H2SO4不能直接氧化Cu,加入氧化性的H2O2可氧化。
(4)实验评价在于比较,一般是从试剂成本、反应时间(生产效率)等方面思考,故后者更合理。
本题难度:一般
4、填空题 现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
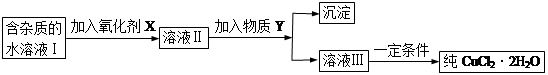

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题 [(1)~(2)小题填标号] :
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7?????????? B.NaClO??????????? C.H2O2??????????????????D.KMnO4
(2)物质Y不可以是___________
A.CuO?????????????B.CuCl2???????????? C.Cu(OH)2?????????????D.CuCO3
(3)若Y为Cu(OH)2,写出除去Fe3+的离子方程式:????????????????????????????
(4)加入氧化剂的目的是_______________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)_______________________________。
参考答案:(1)C? (2)B? (3) 2Fe3+ +3Cu(OH)
本题解析:
试题分析:(1)四种都是强氧化剂,但其他三种加入后会有杂质出现,无法得到纯CuCl2·2H2O,故选C;(2)所加物质为可与氯化铁发生反应生成沉淀,而B不与氯化铁反应;(3)因为Ksp(Fe(OH)3)<Ksp( Cu(OH)2)所以加入Cu(OH)2后生成Fe(OH)3沉淀。(4)Fe3+性质更为稳定,沉淀物更多;(5)不能;应在氯化氢气氛中浓缩后冷却结晶。
本题难度:一般
5、选择题 向含有FeCl3、BaCl2的酸性溶液中通入SO2气体会有沉淀产生,该沉淀是[???? ]
A.BaSO4
B.FeS
C.BaSO3
D.S
参考答案:A
本题解析:
本题难度:一般