微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3 ),具体生产流程如下:
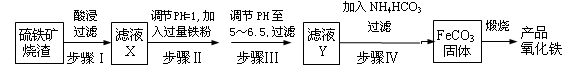
试回答下列问题:
(1)滤液X中含有的金属阳离子是?????????(填离子符号)。
(2)步骤Ⅲ中可选用?????????试剂调节溶液的pH(填字母)。
A.稀硝酸
B.氨水
C.氢氧化钠溶液
D.高锰酸钾溶液
(3)过滤操作中除了玻璃棒、烧杯还需要的玻璃仪器是???????????????????????。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是?????????????????????。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为????????????????????。
参考答案:(1)Fe2+、Fe3+(2)B
(3)普通漏斗
本题解析:
试题分析:(1)酸会和Fe2O3、FeO反应,生成Fe2+、Fe3+,而与SiO2不反应。
(2)调高PH值,需要加入碱,氢氧化钠会和Fe2+离子发生反应生成沉淀,故选B。
(3)过滤操作用到的玻璃仪器为:普通漏斗、玻璃棒和烧杯。
(4)温度不太高,为了是防止NH4HCO3分解,减少Fe2+的水解。
(5)根据提供的反应物和生成物可写成化学方程式。
点评:解答本题时要掌握化学方程式的书写方法和实验方面的知识,只有这样才能对问题做出正确的判断。
本题难度:一般
2、实验题 某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反应的化学方程式为?????????。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是????
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为?????,则假设一成立。
探究2:取1.68g样品在纯氧中灼烧后,若质量为???g,则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00g进行如下实验。
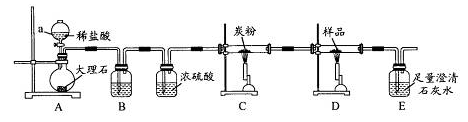
B中的溶液是??????;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为??????;实验装置中有一明显缺陷是??????。
参考答案:
3Fe+4H2O(g)  本题解析:
本题解析:
试题分析:
本题是一道探究性的实验题。铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g)  Fe3O4+4H2
Fe3O4+4H2
上述反应如果铁粉全反应完,那么固体就是Fe3O4,如果铁粉一点都没反应,那就是Fe,当然还有铁粉部分反应,还剩余一部分。得到的是Fe3O4和Fe的混合物。为了验证三种假设,做了以下
本题难度:一般
3、简答题 某工厂的工业废水中含有Fe3+、Cu2+、SO42-等离子,为了减少污染并变废为宝,工厂计划从该废水中回收金属铜并得到硫酸亚铁.生产流程如下图所示(所加试剂均为过量):
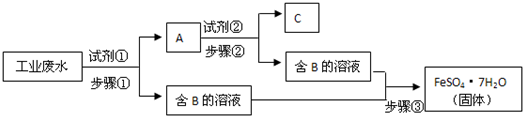
请回答:
(1)试剂①应该是______,A中含有的物质是______.步骤①中发生反应的离子方程式为______.
(2)步骤①、②、③中共同的分离提纯方法是______,步骤③中还需要的分离提纯方法是______.
(3)某同学为了验证长期放置的FeSO4?7H2O固体是否变质,取少量该固体于试管中,加入少量蒸馏水,再滴入几滴______溶液,若观察到______,则证明该固体已经变质.
参考答案:(1)从废水中回收金属铜并得到硫酸亚铁铁粉,因此 应该加入过
本题解析:
本题难度:一般
4、选择题 下列各组物质不能按所示关系实现转化的是表示反应一步完成( )
A.

B.
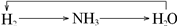
C.
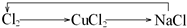
D.

参考答案:D
本题解析:
本题难度:一般
5、选择题 已知铁锈的化学式为Fe2O3。在常温常压下,铁生锈除了需要氧,还必须有下列哪一种物质的存在[???? ]
A.水
B.盐
C.氮
D.氧
E.臭氧
参考答案:A
本题解析:
本题难度:简单