?
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。?
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(填序号)。?
A.c(H+)??????????????????? B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)???????? D.c(OH-)/c(H+)
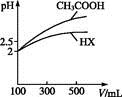
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。?
(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值), = 。? = 。?
参考答案:(1)adcb (2)BD (3)小于 稀释相同倍数,一元酸
本题解析:(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>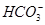 ,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则 ,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则 本题难度:一般 本题难度:一般
2、选择题 常温下测得某无色溶液中由水电离出c(H+)为10-13 mol/L, 该溶液中一定能大量共存的离子组是
A.K+、Na+、NO3-、SO42-
B.K+、Na+、Cl-、CO32-
C.Mg2+、K+、NO3-、Cl-
D.Fe2+、NO3-、SO42-、NH4+
参考答案:A
本题解析:
试题分析:无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,由水电离出c(H+)为10-13mol/L的溶液为酸性或碱性溶液,A、K+、Na+、NO3-、SO42-离子之间不反应,都是无色离子,且都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,A正确;B、酸性溶液中存在大量氢离子,CO32-与氢离子反应生成二氧化碳气体,在溶液中不能大量共存,B错误;C、碱性溶液中,Mg2+与氢氧根离子反应生成难溶物氢氧化镁,在溶液中不能大量共存,C错误;D、Fe2+为有色离子,碱性溶液中,NH4+、Fe2+与氢氧根离子反应,酸性溶液中,NO3-能够氧化Fe2+,在溶液中不能大量共存,D错误;答案选A。
考点:考查离子共存。
本题难度:一般
3、选择题 常温下,向体积为10 mL、物质的量浓度均为0.1 mol/L的盐酸和醋酸的混合溶液中滴入0.1 mol/L NaOH溶液。下列说法错误的是( ???)
A.加入NaOH溶液后,溶液一定满足: c(H+)+c(Na+)=c(OH-)+c(C1-)+c(CH3COO-)
B.加入10 mLNaOH溶液时,溶液满足(溶液体积变化忽略不计):
c(CH3COO-)+c(CH3COOH)="0.05" mol/L
C.加入15 mLNaOH溶液时,呈酸性,溶液满足:
c(Na+)>c(C1-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.加入足量NaOH溶液时,溶液中发生的中和反应的热化学方程式表示为:
H+(aq)+OH-(aq)=H2O(1)? ΔH="-57.3" KJ/mol
参考答案:D
本题解析:
试题分析:A、是止确的电荷守恒表达式,与氢氧化钠溶液的体积无关;B、加入l0 mLNaOH溶液时,溶液体积增倍,根据元素守恒知,正确;C、加入15 mLNaOH溶液时,盐酸完全反应,并得到等物质的量的HAc与NaAc的混合溶液,溶液呈酸性,所以c(CHCOO-)>c(CHCOOH),正确;D、醋酸是弱酸,书写离了方程式时必须保留化学式,ΔH也错,错误。
本题难度:一般
4、选择题 在下列条件下,能大量共存的离子组是
A.c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42-
B.水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42-
参考答案:B
本题解析:
试题分析:A中,c(H+)=1×10-14mol/L的溶液是碱性溶液,Cu2+沉淀;B中,水电离出的c(H+)=1×10-14mol/L的溶液是加入了酸或碱的溶液AlO2-、S2O32-在酸性中不存在,但在碱性中存在;C中,能与Al反应生成H2的溶液是酸或碱的溶液,在碱性时NH4+不存在,在酸性时NO3-产生氮的化合物,不产生H2;D中,能与K3[Fe(CN)6]产生蓝色沉淀的溶液中含有Fe2+,它能被H++CrO42-氧化。
本题难度:一般
5、选择题 在水电离出的c(H+)=1×10-12mol/L的溶液中,一定能大量共存的离子组是
A.Al3+、NH4+、SO42-、Cl-
B.Na+、K+、CO32-、SO42-
C.K+、 Fe2+、Cl-、NO3-
D.Na+、Ba2+、Cl-、NO3-
参考答案:D
本题解析:
正确答案:D
在水电离出的c(H+)=1×10-12mol/L的溶液可能是酸性,也可能是碱性
A.不正确,碱性时Al3+、NH4+均不能大量共存??? B.不正确,(CO3)2-酸性时共存
C.不正确,3Fe2++NO3-+4H+=3Fe3++NO+2H2O?? D.正确,酸性碱条件下都能共存。
本题难度:一般
|