微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.氨氧化成一氧化氮的过程属于氮的固定
B.铝合金制作门窗是利用了其密度小、强度高等性质
C.硫酸铜晶体上滴加浓硫酸逐渐变白,利用了浓硫酸的脱水性
D.F、Cl、Br、I的氢化物稳定性逐渐减弱,其水溶液的酸性也逐渐减弱
参考答案:B
本题解析:分析:A.氮的固定是氮气转化为化合物的过程,包括自然固氮和人工固氮;
B.铝合金的密度小强度高;
C.吸水是指吸收如空气或者其它气体中本来就存在的水蒸气;
D.F、Cl、Br、I的氢化物稳定性逐渐减弱,其水溶液的酸性是逐渐增强的.
解答:A.氨氧化成化合物一氧化氮,属于氮的固定,故A错误;
B.铝合金的密度小强度高,可用作铝合金门窗,故B正确;
C.胆矾的化学式为CuSO4.5H2O,含有结晶水,浓硫酸具有吸水性,是胆矾变成无水硫酸铜,故C错误;
D.F、Cl、Br、I的氢化物稳定性逐渐减弱,其水溶液的酸性是逐渐增强的,一种无氧酸的酸性强弱,取决于其在水溶液中电离出的H+的多少,而电离出的H+的多少与中心原子结合H的能力有关,中心原子结合H的能力越强,则H在水溶液中脱离的难度越大,酸性也就越弱,F、Cl、Br、I中,F是最强的非金属元素,对H的结合能力最强,因此HF是弱酸,而后三者都是强酸,故D错误.
故选B.
点评:本题考查氮的固定、合金、浓硫酸的吸水性、酸性等,难度不大,注意一种无氧酸的酸性强弱,取决于其在水溶液中电离出的H+的多少,而电离出的H+的多少与中心原子结合H的能力有关,中心原子结合H的能力越强,则H在水溶液中脱离的难度越大,酸性也就越弱.
本题难度:困难
2、选择题 既能与盐酸反应又能与氢氧化钠溶液反应的化合物是 [???? ]
①Al??? ②NaHCO3???? ③Al2O3???? ④Mg(OH)2???? ⑤Al(OH)3
A.①②③⑤
B.①④⑤
C.②③⑤
D.①③④
参考答案:C
本题解析:
本题难度:一般
3、计算题 在x mL b mol·L-1 AlCl3溶液中,加入等体积a mol·L-1的NaOH溶液。(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是___________mol。?
(2)当a、b满足_____________条件时,无沉淀生成。
(3)当a、b分别满足___________条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________ mol
参考答案:(1)? ax/3000 (2) a≥4b(3) 3b≤a<
本题解析:
试题分析:Al3++3OH-=Al(OH)3↓、Al3++4OH-=AlO2-+2H2O。当a≤3b时,氢氧化钠少量,生成Al(OH)3物质的量等于ax/3000mol;当氢氧化钠过量时,无氢氧化铝沉淀生成,由n(OH-)≥4n(Al3+)得a≥4b;若要有沉淀生成且溶液中无Al3+生成则3b≤a<4b,生成氢氧化铝物质的量为0.001bxmol,消耗NaOH0.003bxmol,剩余NaOH(0.001ax-0.003bx)nol,溶解的氢氧化铝物质的量为(0.001ax-0.003bx)nol
本题难度:一般
4、实验题 (1 6分)某化学兴趣小组用铝土矿(主要成分为A12 03,还含有Si02及铁的氧化物)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
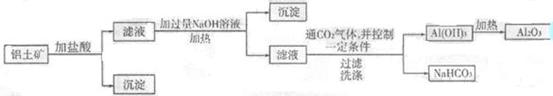
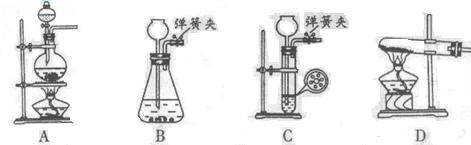
(1)实验室中制取CO2时,为了使反应随开随用、随关随停,应选用下图中的装置
???????????????(填字母代号)。
(2)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有?????????????????;
洗涤沉淀的操作是????????????????????????????????????????????????????????
(3)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式:
????????????????????????????????????????????????????????????????????
此方案中所用药品的物质的量之比是: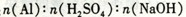 =??????。
=??????。
(4)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,
加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出,铁元素的价态为+3的结论。请指出该结论是否合理并说明理由。
???????????????????????????????????????????????????????????????????
参考答案:
 本题解析:略
本题解析:略
本题难度:简单
5、选择题 向含有1 molKAl(SO4)2的溶液中加入Ba(OH)2溶液,使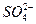 恰好完全沉淀,此时Al(OH)3的物质的量为(???)
恰好完全沉淀,此时Al(OH)3的物质的量为(???)
A.1 mol
B.1.33 mol
C.1.67 mol
D.0
参考答案:D
本题解析:1 mol KAl(SO4)2中含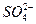 ?2 mol,需Ba(OH)2 2 mol,电离出4 mol OH-,即Al3++4OH-====
?2 mol,需Ba(OH)2 2 mol,电离出4 mol OH-,即Al3++4OH-====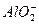 本题难度:简单
本题难度:简单