微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 往含0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
A.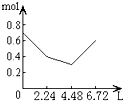
B.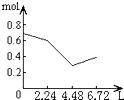
C.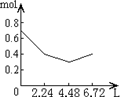
D.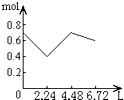
参考答案:n(CO2)=6.
本题解析:
本题难度:简单
2、选择题 下列反应既是离子反应又是氧化还原反应的是[???? ]
A.大理石与稀盐酸
B.硝酸银溶液与氯化钠溶液
C.锌粒与稀硫酸
D.碳跟水蒸气反应
参考答案:C
本题解析:
本题难度:简单
3、选择题 25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,该溶液中一定不能大量存在的离子是
A.NH4+
B.HCO3-
C.SO32-
D.NO3-
参考答案:B
本题解析:分析:25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液,根据离子之间不能结合生成水、气体、沉淀等,则能大量共存,以此来解答.
解答:25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液,
A.酸溶液中氢离子与铵根离子不反应,能共存,故A不选;
B.HCO3-既能与酸反应又能与碱反应,一定不能共存,故B选;
C.碱溶液中离子之间不反应,能共存,故C不选;
D.无论酸或碱溶液中离子之间不反应,能共存,故D不选;
故选B.
点评:本题考查离子的共存,明确习题中的信息是解答本题的关键,熟悉复分解反应发生的条件即可解答,题目难度不大.
本题难度:困难
4、选择题 (改编)25℃时有关物质的颜色和溶度积(KSP)如下表:
物质
| AgC1
| AgBr
| AgI
| Ag2S
|
颜色
| 白
| 淡黄
| 黄
| 黑
|
KSP
| 1.8×10-10
| 7.7×10-13
| 1.5×10-16
| 1.8×10-50
下叙述中不正确的是(???)
A.向AgC1的白色悬浊液中加入少量KI固体,有黄色沉淀产生
B.25℃时,AgCl、AgBr、Agl、Ag2S等四种饱和水溶液中Ag+的浓度相同
C.25℃,AgC1固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D.在10 mL l.8×10-5mol·L-1NaC1溶液中,加入1滴(20滴约为1 mL)
1×10-5mol·L-1AgNO3溶液,不能产生白色沉淀。
参考答案:B
本题解析:根据沉淀转化的规律,因KSP(AgC1)>KSP(AgI),故A正确;因KSP(AgC1)≠KSP(AgBr)≠KSP(AgI),故四种饱和水溶液中Ag+的浓度不相同,由KSP(AgC1)>KSP(AgBr)>KSP(AgI),故c(Cl-)>c(Br-)>c(I-),B错;C项,AgC1的溶度积KSP(AgC1)不受浓度影响,只受温度影响,故C项正确;D项,混合后溶液c(Cl-)=0.01×l.8×10-5mol·L-1/0.01≈l.8×10-5mol·L-1,c(Ag+)=5×10-5×1×10-5
本题难度:一般
5、选择题 某溶液X仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为0.1mol某同学向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化.下列说法正确的是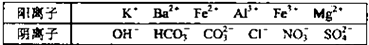
A.溶液X中可能含有HCO-3或CO2-3
B.溶液X中一定不存在Al3+、Ba2+,可能存在K+
C.向反应后的溶液中滴加KSCN溶液,无明显现象
D.向溶液X中加入足量的NaOH溶液,充分反应后过滤将沉淀,洗涤,干燥、灼烧至恒重,能得到固体质量为12g
参考答案:D
本题解析:分析:各种离子的物质的量均为0.1mol某同学向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化.产生气体可能是碳酸根离子或碳酸氢根离子,若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是 Fe2+、NO3-在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,若只含有氯离子和硝酸根离子,二者的量均为0.1mol,根据电何守恒是不可能的,所以还含有硫酸根离子,再根据电荷守恒确定还含有一种带有两个正电荷的镁离子,所以含有的五种离子为:Cl-、NO3-、SO42-;Fe2+、Mg2+;
A、HCO3-与CO32-均可与盐酸反应生成二氧化碳;
B、根据离子共存知识和离子在溶液中的电荷守恒分析来回答;
C、若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,反应后溶液中含有三价铁离子;
D、根据元素守恒,0.1mol的Mg2+产生0.1mol的MgO,质量为4g,0.1mol的Fe2+产生0.05mol的Fe2O3,质量为8g,加起来一共就是12g.
解答:A、往溶液中加入的是过量的盐酸,如果有碳酸根离子或碳酸氢跟离子的话会完全反应生成二氧化碳,所以就不可能保证阴离子种类没变化,HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化;故A错误;
B、依据分析推断可知,结合溶液中电荷守恒,溶液X中一定不存在Al3+、Ba2+、K+,故B错误;
C、反应后溶液中含有三价铁离子,向反应后的溶液中滴加KSCN溶液,溶液呈血红色;故C错误;
D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体是三氧化二铁以及氧化镁,根据原子守恒,则生成0.05molFe2O3和0.1mol的MgO,质量为:0.05mol×160g/mol+0.1mol×40g/mol=12g,故D正确;
故选D.
点评:本题考查了离子性质的应用和实验方案的推断和分析判断,离子共存和离子变化特征,元素守恒和溶液中电荷守恒的计算应用是判断的关键,题目难度较大.
本题难度:困难
|