微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质之间的反应,调节反应物用量,离子方程式不变的是
A.稀硝酸和Fe
B.NaAlO2溶液和盐酸
C.AlCl3溶液和氨水
D.CO2通入NaOH溶液
参考答案:C
本题解析:
本题难度:困难
2、选择题 下列反应的离子方程式正确的是
A.钠与水反应:Na+H2O═Na++OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑
D.NaOH溶液与小苏打溶液反应:HCO3-+OH-═CO32-+H2O
参考答案:D
本题解析:分析:A、离子反应遵循电荷守恒;
B、金属钠和盐溶液反应的实质是先和水反应;
C、碳酸氢钠中含有大量的钠离子和碳酸氢根离子;
D、碳酸氢根离子和氢氧根离子反应生成碳酸根离子和水.
解答:A、钠与水反应的实质为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B、金属钠和盐溶液反应的实质是先和水反应,金属钠不会在溶液中将排在后面的金属置换出来,故B错误;
C、碳酸氢钠中含有大量的钠离子和碳酸氢根离子,碳酸氢根离子是离子团,不能拆,即HCO3-+2H+═H2O+CO2↑,故C错误;
D、碳酸氢根离子和氢氧根离子反应生成碳酸根离子和水,即HCO3-+OH-═CO32-+H2O,故D正确.
故选D.
点评:本题考查离子反应方程式书写的正误判断,明确反应的实质及电荷守恒、质量守恒定律即可解答,难度不大.
本题难度:简单
3、选择题 24 mL浓度为0.05 mol·L-1的Na2SO3溶液(已知硫元素最高价为+6价),恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7(Cr元素最高价为+6价)溶液完全反应,则元素Cr在被还原的产物中的化合价是 ( )。
A.+6
B.+3
C.+2
D.0
参考答案:B
本题解析:依据氧化还原反应中得失电子守恒来计算。Na2SO3失去电子的物质的量为:n=0.024 L×0.05 mol·L-1×2=0.002 4 mol,与K2Cr2O7中Cr原子所得电子的总数是相等的,n(Cr)=0.02 L×0.02 mol·L-1×2=0.000 8 mol,所以每个Cr原子得到的电子数为:0.002 4 mol/0.000 8 mol=3,即化合价降低3价,在K2Cr2O7中Cr为+6价,最后化合价为+3价。
本题难度:一般
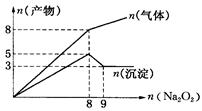
4、选择题 将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量的关系如图所示则原溶液中Al3+、Mg2+、NH4+的物质的量分别为
A.2 mol、3 mol、8 mol
B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、4 mol
参考答案:C
本题解析:
试题分析:2Na2O2 + 2H2O =" 4NaOH" + O2↑?分析图中拐点可以得出,当Na2O2的量为8mol时产生4mol氧气,Al3+、Mg2+、NH4+反应完全,到9mol时,氢氧化铝溶解完全,故有
n(Al3+)=n(Al(OH)3)=2mol
n(NH4+)=n(NH3)=8-4=4mol
n(Mg2+)=n(Mg(OH)2)=3mol
本题难度:一般
5、选择题 在一种酸性溶液中存在NO3―、I―、Cl―、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此推断溶液中
A.一定含有I―,不能确定是否有Cl―
B.一定含有NO3―
C.一定不含有Fe3+、Cl―
D.一定含有I―、NO3―和Cl—
参考答案:A
本题解析:
本题难度:困难