微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5? Ca 40? O 16)
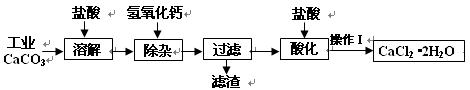
(1)CaCO3与盐酸反应的离子方程式???????????????????????????????。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为???????????????????。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有????????????。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
①??????????????,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括??????????????、?????????????、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L? AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 ???????.(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为??????????????????????????????。
参考答案:(18分)
(1)CaCO3+2H+=Ca2++CO2
本题解析:略
本题难度:一般
2、选择题 常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH4+)>c(SO42-)>c(Fe2+ )>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:D
本题解析:
试题分析:A、从化学式中各离子关系分出大小,相同在考虑水解和电离平衡,0.1 mol·L-1 (NH4)2Fe(SO4)2溶液关系为 c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),错误;B、电荷守恒式应为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),错误;C、质子守恒为c(H+)+c(H2CO3)=c(OH-)+c(CO32-),错误;D、酸过量,溶液为醋酸钠和醋酸混合液,以醋酸电离为主,故有c (CH3COO-)>c (Na+)>c (
本题难度:一般
3、简答题 10℃时,在烧杯中加入0.1mol/L的?NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 50 | 70
pH
8.3
8.4
8.5
8.9
9.4
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为______;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______(填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH______8.3(填“>”、“<”或“=”),说明甲正确,若pH______8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明______(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的?NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断______(填“甲”或“乙”)推测正确,原因是______.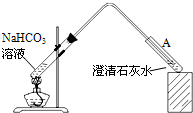
参考答案:(1)碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,水解方
本题解析:
本题难度:一般
4、填空题 常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):???????????????????????。
(2)混合溶液中由水电离出的c(OH-)???????(填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=???????mol·L-1,c(OH-)-c(HA)=???????mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH???????7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3?????B.NH4A????? C.(NH4)2SO4?????D.NH4Cl
按pH由大到小的顺序排列是???????(填序号)。
参考答案:(1)A-+H2O 本题解析:(2)混合溶液由于A-水解,促进水的电离,而NaOH抑制水的电离。 本题解析:(2)混合溶液由于A-水解,促进水的电离,而NaOH抑制水的电离。
(3)一开始c(Na+)=c(A-),但Na+不水解,A-水解,c(Na+)与c(A-)之差即为水解的A-的量。pH=8,c(H+)=10-8 mol·L-1,c(OH-)=10-6 mol·L-1。
由H2O电离的c(OH-)H2O=c(H+)=10-8 mol·L-1
A-+H2O
本题难度:一般
5、选择题 下列过程或现象与盐类水解无关的是
A.0.1 mol·L-1 NaAc溶液中,c (Ac-)小于0.1 mol·L-1
B.镁粉加入氯化铵溶液中有气体生成
C.加热稀氨水其溶液pH值稍有变化
D.加入CuO固体可以除去CuCl2溶液中少量的FeCl3
参考答案:C
本题解析:略
本题难度:简单
|