微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列家庭化学小实验能达到预期目的的是:
A.用米汤检验食用加碘盐(含KIO3)中含有碘
B.用碘酒检验汽油中是否含有不饱和烃
C.提纯蛋白质可以在蛋白质溶液中加饱和CuSO4溶液,蛋白质析出,然后把沉淀溶于蒸馏水中
D.淀粉溶液中加入硫酸加热水解,冷却,加银氨溶液做银镜反应
参考答案:B
本题解析:略
本题难度:一般
2、实验题 工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。?
(2)实验装置(如图所示)
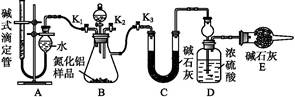
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为n g,滴定管的读数为a mL。
②称取m g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。?
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。?
④ (填入该步应进行的操作)。?
⑤记录滴定管的读数为b mL,称得D装置的质量为p g。
(4)数据分析
①AlN的质量分数为 。?
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。?
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)?
参考答案:(1)②AlN+NaOH+H2O 本题解析:(3)A装置是测量CH4的装置、D装置是吸收NH3的装置,从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3、AlN完全反应,生成甲烷、铵盐,量取生成的甲烷,从而可测得Al4C3的质量分数;用足量NaOH溶液与生成的铵盐反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;(4)①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;③Al4C3的物质的量等于甲烷的物质的量的,可求得Al4C3的质量分数
本题解析:(3)A装置是测量CH4的装置、D装置是吸收NH3的装置,从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3、AlN完全反应,生成甲烷、铵盐,量取生成的甲烷,从而可测得Al4C3的质量分数;用足量NaOH溶液与生成的铵盐反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;(4)①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;③Al4C3的物质的量等于甲烷的物质的量的,可求得Al4C3的质量分数
本题难度:困难
3、实验题 (1)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行
???????次。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、??????????、??????????。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。
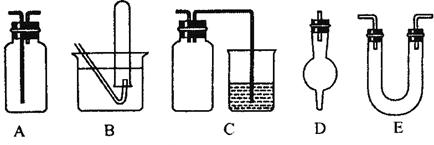
请回答下列问题:
①能用作干燥氨气的装置有_______________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有_______________(填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有________________ (填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有__________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是___________________。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
①可通过观察??????????????来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是??????????;
若不采用A同学的改进方案,你认为还可以如何改进?????????????。
参考答案:(1)4??(1分)(2)环形玻璃搅拌棒(不答环形不得分)、
本题解析:
试题分析:(1)在CuSO4晶体结晶水测定的实验中至少4次称量,分别为:坩埚质量、坩埚和样品质量、灼烧后坩埚和样品质量、再灼烧后坩埚和样品质量。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒。
(3)①氨气为碱性气体,常用碱性干燥剂碱石灰固体干燥,而碱石灰只能填装在D、E中,。
②一氧化氮易与氧气反应,只能用排水法收集。氯气的密度大于空气的,可以用向下排空气法或还饱和食盐水法收集,所以答案选B。
③除去氯气中氯化氢等杂质气体的装置应为洗气瓶,A长用作洗气瓶,故答案为A。
(4)①比较反应速率的大小可通过生成气体的快慢来判断,因此正确的答案是反应产生气泡快慢或反应完成的先后或试管壁的冷热程度。
②比较不同催化剂的催化效果,应排除其它因素的干扰。由于CuSO4、FeCl3中的阴离子不同,不能排除阴离子的因素,所以将FeCl3改为Fe2(SO4)3或将硫酸铜改为氯化铜均可以。
点评:该题是高考中的基本实验题,属于中等难度的试题。本题涉及化学实验操作、气体的净化、收集实验安全、实验探究的等问题,注意A瓶,可用作集气瓶、洗气瓶、安全瓶、量器瓶等,有利于培养学生的综合实验能力,有助于提升学生的学科素养,提高学生的学习效率。
本题难度:一般
4、实验题 某学习小组利用下列装置探究氯气氨气之间的反应,其中A、F分别为氯气和氨气的发生装置,D为纯净的氯气和氨气的反应装置。??
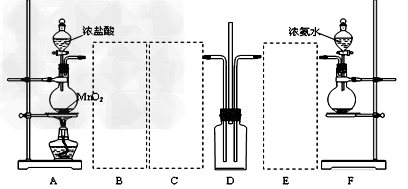
请回答下列问题:
(1)?装置F中烧瓶内的固体可选用_____________。
A、氯化铝???????B、生石灰????C、五氧化二磷????D、烧碱
(2)实验中所用的浓盐酸的质量分数为36.5%,其密度为1.19?g/cm3,则其物质的量浓度为__________(保留一位小数),在标况下需____________L(保留一位小数)氯化氢溶于1L水中才可得此浓度的盐酸。
(3)虚线框内应添加必要的除杂装置,请将除杂装置中相应的试剂名称填入下列空格中:B__________;C_____________;E_____________。
(4)装置D内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子所需要的试剂有:?__________。写出装置D中反应的化学方程式___________。该反应中氧化剂与还原剂物质的量之比为____________。
参考答案:(1)BD?
(2)11.9mol/L;352.7?<
本题解析:
本题难度:一般
5、选择题 某同学想用实验证明高锰酸钾的紫红色是MnO4-的颜色,而不是K+的颜色,他设计了以下实验方案。下列方案中与本实验目的无关的是 [???? ]
A.氯化钾溶液没有颜色,表明溶液中的K+无色
B.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应
C.在高锰酸钾溶液中加入适量锌粉,振荡,静置后紫红色褪去,表明MnO4-为紫红色
D.将高锰酸钾晶体加热分解,所得的固体质量减轻
参考答案:D
本题解析:
本题难度:一般