微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关锂的叙述正确的是
A.锂在空气中燃烧生成过氧化锂
B.根据对角线规则,锂与镁性质相似,蒸发、灼烧氯化锂溶液得到LiCl固体,电解该LiCl得到锂和氯气
C.实验室锂保存在煤油中,防止锂与水、氧气反应
D.“空中焰火”中既有物理变化又有化学变化
参考答案:
D
本题解析:
锂没有钠活泼,在空气中燃烧生成氧化锂,不生成过氧化锂,A错;氢氧化锂是弱碱,氯化锂水解生成氢氧化锂,灼烧得到固体氧化锂,电解得氧气和锂,B错;锂密度小于煤油的密度,应保存在石蜡中,C错;锂的焰色呈红色,焰色反应是物理变化,金属在空气中燃烧是化学变化。
本题难度:简单
2、填空题 建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2
能发生如下反应:
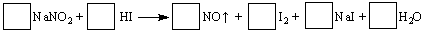
(1)配平上述反应方程式,将系数填入方框中。
(2)上述反应的氧化剂是?????????,若反应中有5 mol电子转移,则生成NO在标准状况下的体积是?????????L。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水;②碘化钾淀粉试纸;③淀粉;④白酒;⑤食醋,进行实验,下列几组合适的是?????????。
A.③⑤
B.①②④
C.①②⑤
D.①②③⑤
参考答案:(1)2NaNO2 + 4HI =2NO + I2 +2 N
本题解析:
试题分析:(1)根据得失电子守恒法配平方程式,亚硝酸钠中N为+3价,反应后降为+2价;HI中I为-1价,反应后成为单质升高为0价,所以答案为2NaNO2 + 4HI =2NO + I2 +2 NaI +2 H2O;
(2)氧化剂是元素化合价降低的物质,所以氧化剂是NaNO2;每生成1molNO,则转移1mol电子,若反应中有5 mol电子转移,则生成5molNO,标准状况下的体积是112L;
(3)根据(2)可知,亚硝酸钠在酸性条件下,可以氧化碘离子为碘单质,碘遇淀粉变蓝色,所以选择的
本题难度:一般
3、选择题 某金属和硝酸反应,已知参加反应的被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若已知还原产物唯一,则还原产物为
A.N2
B.N2O
C.NO
D.NO2
参考答案:A
本题解析:
试题分析:一般的讲,常见的金属的化合价由+1、+2、+3三种情况。当金属和硝酸反应时,二者得失电子数目一定相等。由题意知,设参加反应的被还原的硝酸的物质的量为1mol,未被还原的硝酸的物质的量为5mol,不管生成金属离子是多少价,金属失电子数=5mol,设硝酸的还原产物中氮元素的化合价为x,则氮元素得电子数目=1×(5-x)。因此有:5=1×(5-x),x=0。所以还原产物为N2,故选A。
本题难度:一般
4、填空题 (1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
实验编号
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为 (填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为 。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa
| 2×105
| 5×105
| 1×106
| c(A)/mol·L-1
| 0.08
| 0.20
| 0.44
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为 & #160; mol/L 。(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
参考答案:(1)①5 C + 4
本题解析:
试题分析:(1)①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C→CO2,碳元素化合价由0价升高为+4,共升高4价,化合价最小公倍数为20,故MnO4-系数为4,C系数为5,再根据元素守恒可知Mn2+系数为4、CO2系数为5,根据电荷守恒可知H+系数为12,根据氢元素守恒可知H2O系数为6,配平后离子方程式为5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O,答案:5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O。
(2)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=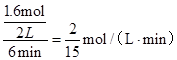 ,速率之比等于化学计量数之比,故v(CO2)=v(CO)= ,速率之比等于化学计量数之比,故v(CO2)=v(CO)=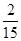 mol/(L·min)=0.13mol/(L·min), mol/(L·min)=0.13mol/(L·min),
故答案为:0.13mol/(L·min);
②、实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放热;
平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g) CO2(g)+H2(g), CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
实验2中达平衡时 CO的转化率为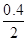 ×100%=20% ×100%=20%
答案:①0.13 mol·L-1 ·min-1; ② 放 ; 20%
(3) ①压强从2×105Pa增加到5×105 Pa时,A的浓度应变化为0.08mol·L-1的2.5倍即为0.20mol·L-1,而图表中变化为0.20mol·L-1,说明平衡不移动,加压时生成物A浓度增大的倍数等于压强增大的倍数;
②压强从2×105 Pa 增加到1×106 Pa时,A的浓度应变化为0.08mol·L-1的5倍即0.40mol·L-1,而图表中A的浓度为0.44mol·L-1,说明平衡逆向进行;根据①可知反应是气体体积增大的反应,所以此时B加压变为液体或固体,当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K=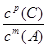
故答案为:①不; ② 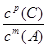 . .
(4 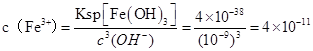 ,答案:4×10-11 ,答案:4×10-11
考点:氧化还原反应方程式的配平;氧化还原反应的计算,化学平衡的影响因素;化学平衡的计算
本题难度:困难
5、选择题 将2mol铜粉放入足量的稀硝酸中进行反应,则反应过程中转移的电子数为(???)
A.4mol
B.2mol
C.8mol
D.6mol
参考答案:A
本题解析:
试题分析:铜与稀硝酸反应,铜失去电子,1mol铜失电子数为2mol。
点评:学会根据元素化合价变化分析得失电子数目。
本题难度:一般
|
|