微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列现象或事实可用同一化学原理加以说明的是[???? ]
A.氯化铵和碘都可以用加热法进行提纯
B.氯水和二氧化硫气体均能使品红溶液褪色
C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质
D.铁片和铝片置于冷的浓硫酸中均无明显现象
参考答案:D
本题解析:
本题难度:简单
2、推断题 在一定条件下可实验下图所示物质之间的变化
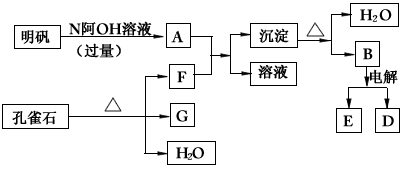
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。上图中的F是____________。
(2)写出明矾与过量NaOH溶液反应的离子方程式:__________________________。
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式________________________________。
(4)每生成1molD,同时生成____________molE。
参考答案:(1)CO2(或二氧化碳)
(2)Al3++4O
本题解析:
本题难度:困难
3、选择题 将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
A.硫酸
B.硝酸钠
C.硫酸锌
D.氯化铜
参考答案:B
本题解析:分析:将铁屑溶于过量的盐酸中,所以说氢离子过量,铁反应完全后,氢离子还有剩余.
A.硫酸不能氧化二价铁离子;
B.硝酸具有强氧化性,可以将二价铁离子氧化为三价铁离子;
C.硫酸锌与二价铁离子不反应;
D.氯化铜与二价铁离子不反应;
解答:盐酸不能把铁氧化到最高价态,将铁屑溶于过量的盐酸中,发生反应:Fe+2HCl=FeCl2+H2↑
A.因为盐酸硫酸不具备强氧化性,不能氧化二价铁离子,所以,没有三价铁离子生成,故A错误;
B.将铁加入过量的盐酸中,铁反应完全后氢离子还有剩余,加入硝酸锌后,硝酸锌溶解,电离出硝酸根离子,而硝酸根离子和氢离子在同一溶液相当于硝酸,而硝酸具有强氧化性,可以将二价铁氧化为三价铁离子,故B正确;?
C.硫酸锌溶解,电离出硫酸根离子,与过量的氢离子在同一溶液,相当于稀硫酸,而稀盐酸硫酸不具备强氧化性,不能氧化二价铁离子,故C错误;
D.氯化铜溶于水,电离出氯离子,与过量的氢离子在同一溶液,相当于稀盐酸,盐酸不能把二价铁离子氧化,故D错误;故选B.
点评:该题主要考查了硝酸的氧化性,解题时须注意,题干和选项不一定明显显示加硝酸,通过先后加入的物质形成硝酸溶液.
本题难度:简单
4、选择题 现有一块铝铁合金,欲测定其铝的质量分数,切下W g合金,溶于盐酸中,再加入过量NaOH溶液,滤出沉淀,将沉淀在空气中充分灼烧,最后得到W g红棕色粉末。则此合金中铝的质量分数约为( )
A.20%
B.30%
C.70%
D.80%
参考答案:B
本题解析:
正确答案:B
由题意,Al和 Fe最后变成Fe2O3,合金中铝的质量分数,就是Fe2O3中氧的质量分数,48÷160×100%=30%
本题难度:简单
5、填空题 (12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验:
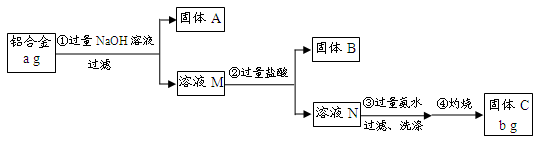
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是????????????;
(2)生成固体B的离子方程式为????????????????????????????;
步骤③中生成沉淀的离子方程式为?????????????????????????????????;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为????????????????????????
????????????????????????????????????????????????????????????;
(4)该样品中铝的质量分数是?????????????????????????;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是?????????????????????;
A.第①步中加入NaOH溶液不足
B.第②步中加入盐酸不足时
C.第③步中沉淀未用蒸馏水洗涤
D.第④步对沉淀灼烧不充分
参考答案:(1)Mg、Cu????????
(2)SiO32-+
本题解析:
试题分析:⑴根据铝合金的主要成分为铝、镁、铜、硅,只有铝、硅与过量NaOH溶液反应溶解,则过滤所得固体A的成分是Mg、Cu;
⑵溶液M中主要含有NaAlO2、Na2SiO3,加入过量盐酸,Na2SiO3与盐酸反应生成H2SiO3沉淀(固体B);溶液N中主要含有AlCl3,步骤③加入过量氨水与其反应生成Al(OH)3沉淀;
⑶步骤③洗涤沉淀表面上的可溶性杂质NaCl、NH4Cl;用AgNO3溶液可检验沉淀是否洗涤干净;
⑷据题意知固体C为Al?2O3,据铝原子守恒可计算出样品中铝的
本题难度:一般