微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是( )
A、锌与稀硫酸反应 Zn + 2H+ = Zn2+ + H2#
B 铜与硝酸银溶液反应 Cu + Ag+ = Cu2+ + Ag
C 碳酸钙与盐酸反应 CaCO3 + 2H+ = Ca2+ + CO2# + H2O
D 硫酸与氢氧化钡溶液混合 SO42- + Ba2+ = BaSO4
参考答案:AC
本题解析:选项B中电子得失不守恒,应该是Cu +2 Ag+ = Cu2+ +2 Ag。选项D中还有水生成,应该是SO42- + 2H+ +2OH-+ Ba2+ = BaSO4 +2 H2O,因此正确的答案选AC。
本题难度:一般
2、填空题 (本题共17分)铁元素、氮元素有多种可变价态,在氧化还原反应中常以不同价态出现,根据题中信息,完成下列填空:
28.金属与硝酸反应通常还会生成NO和NO2,当n(NO): n(NO2)<1时,产生的气体可以完全被氢氧化钠溶液吸收,写出除去这两种气体的方法,以化学方程式表示 、
29.室温下,0.1mol/L的亚硝酸、次氯酸钠的电离常数HNO2:Ki ="7.1×" 10-4, HClO: Ki ="2.98×" 10-8,将0.1mol/L的亚硝酸稀释100倍,c(H+)=将(填“不变”、“增大”、“减小”) ;Ki值将(填“不变”、“增大”、“减小”) 。写出HNO2、HClO、NaNO2、NaClO四种物质,可能相互之间发生的离子互换反应的离子方程式 。
30. 亚硝酸钠与氯酸钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生红棕色刺激性气味气体,该气体为 ;实验室鉴别氯化钠和亚硝酸钠的方法之一是测定等浓度NaNO2、NaClO的pH,其鉴别的理由是 。
31.现有11.2g铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为 ,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,铁与稀硝酸的反应产物中一定含有的金属阳离子是 ,若反应后的溶液最多可溶解铜粉6.4g,写出上述过程中铁与稀硝酸反应的化学方程式 。
参考答案:(30题第二问2分,31题第三问2分,其余每空1分)28.
本题解析:
试题分析:28.当n(NO): n(NO2)<1时,产生的气体可以完全被氢氧化钠溶液吸收,这说明NO2能与氢氧化钠溶液反应,则根据氮元素的化合价可知生成物是硝酸钠、亚硝酸钠和水。如果是NO和NO2同时通入水中则生成亚硝酸钠和水,反应的化学方程式分别是2NaOH+ NO2+ NO → 2NaNO2 +H2O、2NaOH+NO2 → NaNO2 + NaNO3 + H2O。
29. 稀释亚硝酸促进电离,当氢离子浓度减小。电离平衡常数只与温度有关系,则Ki值将不变;电离平衡常数越大,酸性越强,则酸性强弱是亚硝酸强于次氯酸。根据较强酸制备较弱酸可知HNO2能与次氯酸钠反应生成次氯酸,反应的离子方程式为HNO2+ClO2-→NO2- + HClO。
30.亚硝酸钠遇到白醋会产生红棕色刺激性气味气体,该气体为NO2。由于亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,为中性,所以它们同浓度的盐溶液的pH不同,因此实验室鉴别氯化钠和亚硝酸钠的方法之一是测定等浓度NaNO2、NaClO的pH。
31. 现有11.2g铁单质恰好与稀硝酸反应,生成无污染的单质气体,则该单质气体为氮气。在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,这说明溶液中含有铁离子,而没有硝酸,所以铁与稀硝酸的反应产物中一定含有的金属阳离子是Fe3+ 。若反应后的溶液最多可溶解铜粉6.4g,即0.1mol铜,根据方程式2Fe3++Cu=2Fe2++Cu2+可知溶液中铁离子的物质的量是0.2mol。铁的物质的量是11.2g÷56g/mol=0.2mol,即全部转化为铁离子,所以上述过程中铁与稀硝酸反应的化学方程式为10Fe+36HNO3 →10Fe(NO3)3+3N2↑+18H2O。
考点:考查电离平衡常数应用、盐类水解以及氧化还原反应的应用等
本题难度:困难
3、选择题 下列离子方程式的书写正确的是
A.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
B.NaHCO3溶液与NaOH溶液反应: OH
参考答案:
本题解析:
本题难度:一般
4、填空题 (12分)根据下图所示的关系,确定A、B、C、D、E、F的化学式,并写有关方程式。
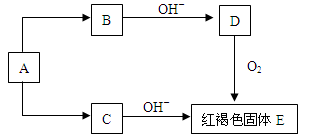
(1)已知A为单质,则A为 (填化学式,下同),E为 。
(2)D→E的化学方程式为___________________________________。
(3)取少量C溶于水,加入酸化的硝酸银溶液,有白 色沉淀生成,则A→C的化学方程式为_____________________________。
(4)某学习小组设计如下装置进行相关实验:
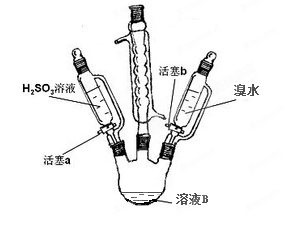
①打开活塞b,向溶液B中逐滴加入少量溴水,关闭活塞b;
②打开活塞a,向容器中滴入足量的亚硫酸。
按要求回答下列问题:
①滴入溴水时,溶液的颜色变为棕黄色,该反应的离子方程式为________。
②滴入亚硫酸时,溶液由棕黄色变为浅绿色,该反应的离子方程式为______。
③由此可知,B中的阳离子、Br-、H2SO3还原性由强到弱的顺序是___________(B中的阳离子用离子符号表示)。
参考答案:(1)Fe,Fe(OH)3 (2)4Fe(OH)
本题解析:
试题分析:E是红褐色固体,则E是氢氧化铁,氢氧化亚铁和氧气反应生成氢氧化铁,所以D是氢氧化亚铁,B与碱能反应生成氢氧化亚铁,则B是亚铁盐,C是铁盐,,A为单质,则A是铁。
(1)A为Fe,E为Fe(OH)3。
(2)氢氧化亚铁生成氢氧化铁的化学方程式为4Fe(OH) 2+O2+2H2O=4Fe(OH)3。
(3)取少量铁盐溶于水,加入酸化的硝酸银溶液,有白色沉淀生成,说明该物质为氯化铁,则铁生成氯化铁的化学方程式为2Fe+3Cl2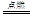 2FeCl3;
2FeCl3;
(4)溶液B是亚铁盐,①滴入溴水时,溶液的颜色变为棕黄色,铁离子棕黄色,说明溴水与亚铁离子反应,离子方程式为2Fe2++Br2=2Fe3++2Br-。②滴入亚硫酸时,溶液由棕黄色变为浅绿色,说明亚硫酸能将Fe3+还原成Fe2+,该反应的离子方程式为2Fe3++ H2SO3= 2Fe2++SO42-+2H+。③根据还原剂的还原性大于还原产物的还原性,由此可知,Fe2+、Br-、H2SO3还原性由强到弱的顺序是H2SO3>Fe2+>Br-.
考点:考查铁及其化合物的化学性质,氧化还原反应等知识。
本题难度:困难
5、填空题 硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol?L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
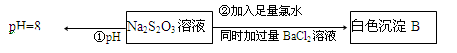
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
参考答案:(1)SO2+OH—=HSO3—;因有HSO3—存在,HSO
本题解析:
试题分析:(1)由已知:n(NaOH)=1mol?L-1 × 0.1L=0.1mol
n(SO2)=0.1mol,则SO2+OH-=HSO3-;
亚硫酸氢钠溶液呈酸性因为:HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-
其中电离程度大于水解程度,故亚硫酸氢钠溶液呈酸性;
以石墨作电极,电解该物质的饱和溶液时,阳极H+放电会生成H2,则 阳极无气体应为HSO3-放电,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+;
(2)Na2SO3溶液中,SO32-水解显碱性,离子浓度大小比较为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),Na2SO3溶液放置于空气中一段时间后被氧化:2Na2SO3+O2=2Na2SO4,溶液从碱性变化为中性,pH减小;
(3)由已知:实验①测定溶液pH=8:
A.溶液pH=8,呈碱性,则c水(OH-)=10-6mol/L,故A错误;
B.S2O32-水解显碱性,证明H2S2O3是弱酸,故B正确;
C.Na2S2O3是钠盐为强电解质,故C错误;
D.H2S2O3为二元弱酸,S2O32-水解应分步进行,故D错误;
实验②Cl2将Na2S2O3氧化为Na2SO4,加BaCl2生成BaSO4反应的离子方程式:
S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
(4)①由于高锰酸钾溶液呈紫红色可作指示剂,当滴入最后一滴溶液呈紫红色,半分钟不褪色,即可指示出滴定终点。因此不需要指示剂。高锰酸钾为强氧化性溶液,可使用酸式滴定管;
②刚看到溶液局部变色就停止滴定,反应并未达到滴定终点,测得的高锰酸钾溶液体积偏低,因此测量结果会偏低;
③n(KMnO4)="0.40mol/L" ×0.020L=0.008mol,则由反应方程式:
5S2O32-+8MnO4-+14H+=8Mn2++10SO42-+7H2O
5 8
n 0.008mol
n=0.005mol
产品中Na2S2O3?5H2O的质量分数=0.005mol×248g/mol/1.28g×100%=96.9%,
考点:了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。了解化学实验是科学探究过程中的一种重要方法。了解化学实验室常用仪器的主要用途和使用方法。能做到设计、评价或改进实验方案。
点评:本题考查了盐类水解应用、离子浓度大小比较、电解原理及应用、氧化还原滴定及指示剂的确定、实验误差分析等知识点,综合性较强,要求学生熟练掌握基础知识,同时要善于进行知识迁移。
本题难度:困难