微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,水的离子积常数KW=10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为
A.1∶10
B.9∶1
C.10∶1
D.99∶21
参考答案:B
本题解析:该温度下中性溶液的pH=6,故当混合溶液的pH=7,则说明中和过程中碱过量
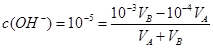 ,得
,得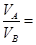 9:1,答案为B
9:1,答案为B
本题难度:一般
2、填空题 (8分)25OC时,0.1 mol/LHCl溶液中,[Cl-] =__________,[ OH-] =___________,Kw=______________;
若向15mL此溶液中加入15mL 0.3 mol/L NaOH溶液,则混合液pH=________。
参考答案:(8分)0.1 mol/L ;1.0×10-13 mol/
本题解析:略
本题难度:一般
3、填空题 测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否不断溶解?________(填“能” 或“不能”),理由是____________________________________________________。
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果________(填“偏高”“偏低”或“无影响”)。原因是_________________________________________________
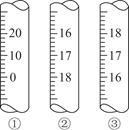
(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选________(填序号),在滴定接近终点时,应用蒸馏水润洗锥形瓶内壁,目的是________________________________________________________
参考答案:(1)不能 因为酚酞的变色范围为8~10,即pH范围呈碱性,
本题解析:详见答案
本题难度:一般
4、选择题 有①Na2CO3??②CH3COONa???③ NaOH???④C6H5ONa溶液各25 mL,
物质的量浓度均为0.1 mol·L-1,下列说法正确的是????
A.4种溶液的PH的大小是③>②>④>①
B.若将4种溶液稀释相同的倍数,PH变化最大的是②
C.若分别加入25 mL0.1 mol·L-1盐酸后,PH最大的是①
D.若4种溶液的PH均为9,则物质的量浓度大小顺序是③>①>②>④
参考答案:C
本题解析:强碱弱酸盐,酸越弱水解程度越大,因为酸性醋酸>碳酸>苯酚,所以水解程度④>①>②,PH③>④>①>②,A错误。若将4种溶液稀释相同的倍数,PH变化最大的是④,PH变化最小的是③。若4种溶液的PH均为9,则物质的量浓度大小顺序是③>②>①>④
本题难度:简单
5、选择题 下图是向25.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH变化的图象,根据图象分析,下列结论中不正确的是?
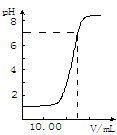
A.盐酸起始浓度为0.10 mol·L-1
B.NaOH溶液浓度为0.10 mol·L-1
C.滴到中点时,耗NaOH物质的量为0.0025mol
D.滴入碱量为20.00mL时,向混合溶液中滴入2滴酚酞试液,溶液显红色
参考答案:D
本题解析:
试题分析:D项:碱量为20.00mL时,溶液还呈酸性,故不显红色,故错。故选D。
点评:本题考查的是中和滴定时溶液的PH计算,指示剂的显色范围。难度中。注重对教材知识的学习。
本题难度:一般