微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 熔融烧碱样品应使用下列哪种器皿
A.石英坩埚
B.氧化铝耐高温坩埚
C.生铁坩埚
D.瓷坩埚
参考答案:C
本题解析:A石英坩埚有二氧化硅,会和烧碱样品反应,不能用石英坩埚熔化。
B 氧化铝也能和烧碱样品反应,不能用氧化铝耐高温坩埚熔化烧碱样品
C 铁和烧碱不反应,能用生铁坩埚熔化烧碱样品
D瓷坩埚中含有二氧化硅,也不能熔化烧碱样品。故选C。
本题难度:一般
2、实验题 (8分)
为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。
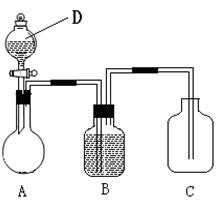
请据此实验回答下列问题:
(1)仪器D的名称是______________,所盛放的试剂应为?????????????(填化学式);
(2)在烧瓶中装某可溶性正盐溶液,则A中反应的离子方程式是______________;
(3)装置B中所盛的试剂是??????????????,其作用是?????????????????????;
(4)装置C中所盛的试剂是??????????,C中反应的化学方程式是???????????? _;
(5)根据该实验可以得出C6H5OH、H2CO3、CH3COOH这三种物质的酸性强弱顺序为
_________________________________________________。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
3、选择题 下列能达到实验目的的是??(??????)
A.用NaOH溶液除去CO2中混有的HCl气体
B.用分液漏斗分离四氯化碳和水的混合物;
C.加入盐酸以除去硫酸钠中的少许碳酸钠杂质
D.配制一定浓度的氯化钾溶液1000mL,准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容
参考答案:B
本题解析:
试题分析:NaOH不仅能吸收CO2还能吸收HCl。用盐酸除去硫酸钠中的少许碳酸钠杂质,会引入新的杂质。容量瓶是配制溶液的仪器,不是溶解的仪器,溶解应该在烧杯中进行。答案选B。
点评:本题基础性强,难度小。
本题难度:一般
4、选择题 有一支50mL酸式滴定管中盛盐酸,液面恰好在a mL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是
A.大于(50-a)mL
B.大于a mL
C.(50-a) mL
D.a mL
参考答案:A
本题解析:滴定管0刻度以下尖嘴部分没有刻度,液体全部放出放出时,尖嘴部分的液体也放出了,从而使得放出的液体体积大于a mL。
本题难度:简单
5、实验题 某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:

Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 ???????b.氯化钙?????? c.五氧化二磷 ??????d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子__________________________________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________________________________________________________。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是_________________________________________________________________。
参考答案:(1)D ad
(2)饱和食盐水、浓硫酸
(3)
本题解析:(1)制取NH3,可用浓氨水的分解制备,然后再用碱石灰或生石灰干燥,但不能用CaCl2,因为CaCl2可结合NH3生成CaCl2·8NH3。(2)制取干燥纯净的Cl2,可用饱和食盐水除HCl,再用浓H2SO4干燥Cl2。(3)应向烧瓶中先通Cl2,再通NH3,因为Cl2有颜色,便于观察;一开始若通NH3,由于弹簧夹3打开,容易形成喷泉。证明NH要注意“操作→现象→结论”,同时还要注意细节,如浓NaOH,加热,湿润等。(4)可利用Cl2+2NaBr=2NaCl+Br2,证明还原性Br->Cl-。(5)CH2
本题难度:困难