微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)短周期主族元素A、B、C、D、E原子序数依次增大,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 。
(2)已知:
① E-E→2E △H=+a kJ/mol;
② 2A→A-A △H=-b kJ/mol;
③ E+A→A-E △H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) △H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) △H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
|
初始投料
| 2 molA2、1 molBC
| 1 molX
| 4 molA2、2 molBC
|
平衡时n(X)
| 0.5mol
| n2
| n3
|
反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
|
体系的压强
| P1
| P2
| P3
|
反应物的转化率
| 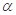 1 1
| 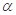 2 2
| 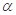 3 3
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率v (A2)= 。
②计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1
B.Q1+Q2=Q
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
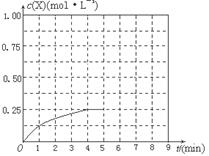
④在其他条件不变的情况下,将甲容器的体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。
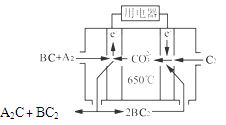
现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
参考答案:(14分,每空各2分)(1)离子键、极性键(或共价键)
本题解析:
试题分析:短周期主族元素A、B、C、D、E原子序数依次增大,A是元素周期表中原子半径最小的元素,则A是氢元素。B是形成化合物种类最多的元素,则B是碳元素 。C原子的最外层电子数是次外层电子数的3倍,所以C是氧元素。D是同周期中金属性最强的元素,则D是钠元素,E的负一价离子与C的某种氢化物分子含有相同的电子数,因此E是氯元素。
(1)A、C、D形成的化合物是氢氧化钠,其中含有的化学键类型为离子键、极性键(或共价键)。
(2)已知:① E-E→2E △H=+a kJ/mol;② 2A→A-A △H=-b kJ/mol;③ E+A→A-E △H=-c kJ/mol,则根据盖斯定律可知①+③×2—②即得到A2与E2反应的热化学方程式H2(g)+Cl2(g)=2HCl(g) △H=(a+b-2c)kJ·mol-1。
(3)①依据原子守恒可知X是甲醇,根据表中数据可知甲中平衡时生成甲醇是0.5mol,则根据方程式可知消耗氢气是1mol,浓度是0.5mol/L,所以在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率v (A2)=0.5mol/L÷4min=0.125mol·L-1·min-1。
②根据①中分析可知平衡时氢气、CO和甲醇的物质的量分别是1mol、0.5mol和0.5mol,浓度分别是0.5mol/L、0.25mol/L、0.25mol/L,所以该温度下此反应的平衡常数K=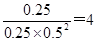 。 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.乙容器中的1mol甲醇换算成反应物是2mol氢气和1molCO,即甲、乙中平衡是等效的,所以α1+α2=1,A正确;B.根据以上分析可知甲、乙中平衡等效,则Q1+Q2=Q,B正确;C.丙相当于在甲的基础上增大压强,平衡向正反应方向进行,转化率增大,即α1<α3,C错误;D.丙相当于在甲的基础上将容器容积进行一般,增大压强,平衡向正反应方向进行,根据勒夏特例原理可知再次平衡时丙中压强小于甲中压强的2倍,即P3<2P1=2P2,D正确;E.根据以上分析可知n3=2n2>1.0mol,E错误; F.丙相当于在甲的基础上增大压强,平衡向正反应方向进行,则Q3>2Q1,F错误,答案选ABD。
④在其他条件不变的情况下,将甲容器的体积压缩到1L,则瞬间甲醇的浓度增大一倍,平衡向正反应方向进行,甲醇浓度开始再逐渐增大,若在第8min达到新的平衡时氢气的总转化率为75%,根据方程式可知平衡时生成甲醇2mol×0.75/2=0.75mol,浓度是0.75mol/L,所以第5min 到新平衡时甲醇的物质的量浓度的变化曲线可表示为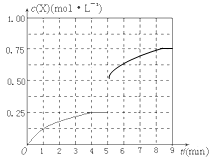 。 。
(4)燃料电池中氧气再正极得到电子,发生还原反应。由于是熔融的碳酸盐为电解质,则正极反应式为O2+4e-+2CO2=2CO32-。
考点:考查元素推断、化学键、盖斯定律、外界条件对平衡状态的影响、平衡状态计算及燃料电池应用
本题难度:困难
2、选择题 化学中常借助曲线图来表示某种变化过程,如图:下列曲线图中从左到右依次表示上述过程中的
①平衡移动过程 ②中和滴定过程
③沉淀的生成和溶解 ④固体物质的溶解度变化过程

A.①②③④
B.②③①④
C.④③②①
D.②①③④
参考答案:D
本题解析:
试题分析:曲线图中从左到右依次表示②中和滴定过程、①平衡移动过程、③沉淀的生成和溶解、④固体物质的溶解度变化过程,选D。
考点:考查化学反应图像的判断与分析。
本题难度:一般
3、选择题 汽车尾气净化中的一个反应如下:NO(g)+CO(g)= N2(g)+CO2(g) ΔH=-373.4KJ/mol N2(g)+CO2(g) ΔH=-373.4KJ/mol
若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是
A.其它条件不变,加入催化剂,ΔH变大
B.及时除去二氧化碳,正反应速率加快
C.降低温度,可提高反应物的转化率
D.若气体的密度保持不变,说明平衡不发生移动
参考答案:C
本题解析:
试题分析:A.其它条件不变,加入催化剂,反应速率改变,但是ΔH不变,错误;B.及时除去二氧化碳,即减小生成物的浓度,平衡正向移动,正反应速率由于生成物的浓度减小,所以正反应速率减慢,错误;C.降低温度,平衡向放热的正反应方向移动,因此可提高反应物的转化率,正确;D.由于反应是在恒温、恒容的密闭容器中进行,反应前后气体的质量不变,所以在任何时刻都存在气体的密度不变,因此气体的密度不变,不能说明平衡不发生移动,错误。
考点:考查化学反应速率、化学平衡及物质的转化率的影响的知识。
本题难度:一般
4、选择题 已知反应①:CO(g)+CuO(s)?CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)?Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( ) A.反应①的平衡常数K1=[c(CO2)?c(Cu)]/[c(CO)?c(CuO)]
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,温度升高,H2 的浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2 的浓度一定减小
参考答案:B
本题解析:
本题难度:一般
5、选择题 某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)?C(g)+D(g),当下列物理量不发生变化时:
①混合气体的密度?
②容器内气体的压强?
③混合气体的平均相对分子质量?
④B的物质的量浓度??
则能表明该反应一定已达到平衡状态的是( )
A.只有④
B.②③
C.②③④
D.①③④
参考答案:①该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体
本题解析:
本题难度:简单
|