微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
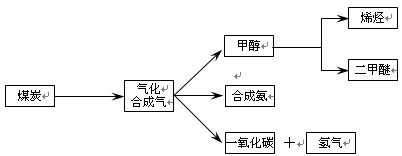
(1)已知该产业链中某反应的平衡表达式为:K=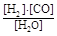
它所对应反应的化学方程式为????????????????????????????????????????????。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g) 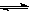 ?2CO(g),K1
?2CO(g),K1
CO(g)+H2O(g) 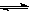 ?H2(g)+CO2(g),K2
?H2(g)+CO2(g),K2
C(s)+H2O(g) 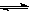 ?CO(g)+H2(g),K3
?CO(g)+H2(g),K3
则K1、K2、K3之间的关系为??????????????????????????。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)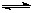 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下: