微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是( )
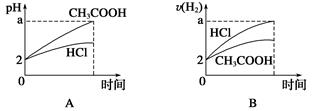
参考答案:C
本题解析:镁最多失去电子的物质的量为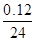 ×2=0.01 mol。A、B项,在反应过程中,CH3COOH进一步电离,CH3COOH的pH小于HCl的pH,生成氢气的速率,v(CH3COOH)>v(HCl),A、B均错;C、D项,由于Mg是定量的,HCl恰好完全反应,而CH3COOH过量,且CH3COOH与Mg反应速率快,所以C
×2=0.01 mol。A、B项,在反应过程中,CH3COOH进一步电离,CH3COOH的pH小于HCl的pH,生成氢气的速率,v(CH3COOH)>v(HCl),A、B均错;C、D项,由于Mg是定量的,HCl恰好完全反应,而CH3COOH过量,且CH3COOH与Mg反应速率快,所以C
本题难度:简单
2、选择题 某温度下, 相同pH的盐酸和醋酸溶液分别加水稀释, pH 随溶液体积变化的曲线如图所示。据右图判断正确的是

A.Ⅱ为盐酸稀释时的pH变化曲线
B.a点KW的数值比c点KW的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
参考答案:C
本题解析:
试题分析:II应为醋酸稀释时的pH值变化曲线,故A错误;KW的大小只取决于温度,故B错误;溶液导电性取决于离子浓度,b点的H+浓度大,导电性强,故C正确;相同pH值的盐酸和醋酸,醋酸浓度远大于盐酸的浓度,稀释到相同体积时,醋酸(II)浓度大于盐酸(I)浓度,故D错误;答案选C.
考点:弱电解质的电离
本题难度:一般
3、选择题 若以w1、w2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知2a=b,则下列推断正确的是[???? ]
A.w2>2w1
B.2w1=w2
C.2w2=w1
D.w1<w2<2w1
参考答案:A
本题解析:
本题难度:一般
4、填空题 (6分)某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 ;
(2)c(H2A)最大的是 ,最小的是 ;
(3)c(A2-)最大的是 ,最小的是 。
参考答案:(1)A , D (2)C, D (3)D,A
本题解析:
试题分析:
0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液HCL与NaHA反应:NaHA+HCl=NaCl+H2A,所以C中相当于含有0.01mol/LH2A 和0.01mol/LNaHA;0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合NaOH+NaHA=Na2A+H2O 所以D中相当于含有0.01mol/LNa2A,因此,
A、0.01mol/L的H2A溶液B、0.01mol/L的NaHA溶液
C、0.01mol/LH2A 和0.01mol/LNaHA D、0.01mol/LNa2A
(1)因弱酸的一级电离为酸性的主要来源,明显只有A、C具有弱酸;而C中HA-会抑制同浓度弱酸的电离,故较小,只有D为正盐,水解程度最大,c(H+)最小,故答案为:A;D;
(2)因C中电离比A小,留下的就比A大,故c(H2A)最大;D中正盐二级水解生成弱酸最难,故c(H2A)最小,故答案为:C;D;
(3)因正盐留下的A2-浓度必最大;弱酸二级电离成A2-最难,故答案为:D;A.
考点:考查弱电解质的电离平衡、盐类的水解
点评:本题考查了弱电解质的电离平衡、盐类的水解,难度中等。本题的难点是C、D关于混合溶液的离子浓度大小的判断。
本题难度:困难
5、选择题 用水稀释0.5mol·L—1的醋酸(CH3COOH)溶液,其中随水量的增加而增大的是:
①H+的物质的量 ②C(H+) ③C(H+)/C( CH3COO—)
④C(CH3COOH)/ C(CH3COO—) ⑤C(OH
参考答案:
本题解析:
本题难度:一般