微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是
A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B.反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.CH3COOH溶液加水稀释后,溶液中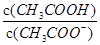 的值减小
的值减小
参考答案:AD
本题解析:
试题分析:镀层是铜,当镀层破坏时,易形成电化学腐蚀而使相对活泼金属被腐蚀,即铁的腐蚀会加剧A正确;该反应不能自发进行说明△H-T△s>0,由于△s>0,所以△H>0,B错误;升高温度,反应速率v(H2)增大,但平衡左移氢气的平衡转化率均减小C错误;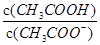 =c(H+)/Ka, c(H+)减小、Ka不变,故
=c(H+)/Ka, c(H+)减小、Ka不变,故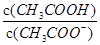 的值减小D正确
的值减小D正确
考点:金属的化学腐蚀、ΔH的判断、平衡的移动、弱电解质的电离
本题难度:一般
2、填空题 常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号
| HA的物质的
量浓度(mol·L-1)
| NaOH的物质的
量浓度(mol·L-1)
| 混合后溶
液的pH
|
甲
| 0.1
| 0.1
| pH=a
|
乙
| 0.12
| 0.1
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=10
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。
参考答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
本题解析:(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐溶液的pH,a=7时为强酸,a>7时为弱酸;(2)据电荷守恒,有c(Na+)+c(H+)=c(A-)+c(OH-),因c(H+)=c(OH-),所以c(Na+)=c(A-);(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的电离,离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+);(4)据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),推导c(Na+)-c(A-)=c(OH-)-c(H+)=10-4 mol/L-10-10 mol/L。
本题难度:困难
3、选择题 等质量的三份锌a、b和c,分别加入足量的稀硫酸中,a中同时加入适量CuSO4溶液,b中加入适量CH3COONa溶液,C中不加入其他物质.下列各图中表示其产生H2的总体积(V)与时间(t)的关系中正确的是( )
A.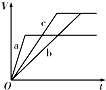
B.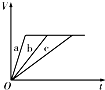
C.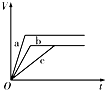
D.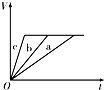
参考答案:锌和硫酸反应,加入硫酸铜,会置换出金属铜,形成锌、铜、稀硫酸
本题解析:
本题难度:简单
4、填空题 有pH均为2的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是??????????(用“>、<、=”表示,下同)。
(2)取同体积的三种酸溶液分别加入足量的锌粉,反应开始放出H2的速率依次为a1、a2、a3,则其关系是?????????????;反应过程中放出H2的速率依次为b1、b2、b3,则其关系是????????????????????
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是????????????????。
参考答案:(1)C3>C1>C2???(2)a1=a2=a
本题解析:略
本题难度:简单
5、选择题 某氨水中c(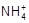 )=0.5 mol / L时达到电离平衡,若向其中加入c( )=0.5 mol / L时达到电离平衡,若向其中加入c(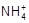 )=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将???????????????????????????????????(???) )=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将???????????????????????????????????(???)
A.减少
B.不变
C.增大
D.无法判断
参考答案:C
本题解析:
正确答案:C
加入c(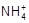 )=0.5 mol / L的NH4Cl溶液后,NH3·H2O的体积扩大一倍,NH3·H2O的平衡向电离方向移动,NH3·H2O的电离程度将境大。 )=0.5 mol / L的NH4Cl溶液后,NH3·H2O的体积扩大一倍,NH3·H2O的平衡向电离方向移动,NH3·H2O的电离程度将境大。
本题难度:简单
|