微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在水溶液中呈橙红色的Cr2O72-与呈黄色的CrO42-有下列平衡关系:Cr2O72-+H2O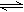 2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1)取少许上述溶液加入NaOH溶液,溶液变_________色,因为___???________。
⑵向⑴中再加入过量稀H2SO4,则溶液呈__???__色,因为__________????????????????_________。
⑶取少许原溶液,向其中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡_____???????????____,溶液颜色将_____?????????????????____。
参考答案:(1)黄??加入NaOH中和了H+,使c(H+)降低,平衡向
本题解析:考查外界条件对化学平衡的影响。
(1)加入氢氧化钠,中和溶液中的氢离子,氢离子浓度降低平衡向正反应方向移动,c(Cr2O72-)减小,c(CrO42-)增大,溶液显黄色。
(2)再加入硫酸,溶液中c(H+)增大,平衡向逆反应方向移动,c(CrO42-)降低,c(Cr2O72-)增大,所以显橙红色。
(3)加入Ba(NO3)2溶液,则生成BaCrO4黄色沉淀,c(CrO42-)降低,平衡向正反应方向移动,溶液的颜色将逐渐变浅,直到无色。
本题难度:一般
2、选择题 一定条件下,向容积为2L的密闭容器中通入0.2 mol CO和0.2mol H2O,发生如下反应:
CO(g) +H2O(g) = CO2(g)+H2(g)(且l mol CO气体完全反应放出a kJ热量),4 min后反应达到平衡,测得c(CO):c( CO2) = 3:2。下列说法正确的是 [???? ]
A.反应放出的热量为0.2 a kJ
B.前4 min反应的平均速率v(CO) =0.015 mol·L-1·min-1
C.达到化学平衡时H2的体积分数为40%
D.平衡时H2O的转化率为40%
参考答案:D
本题解析:
本题难度:一般
3、选择题 在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)  ?CO(g)+H2(g);
?CO(g)+H2(g);
乙:CO(g)+H2O(g)  ?CO2(g)+H2(g)
?CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变 ⑦单位时间内,消耗水质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤
B.③④⑥
C.⑥⑦
D.④⑤
参考答案:D
本题解析:
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,乙中气体的质量和物质的量都是不变的,不能说明;同样乙中压强不再发生变化时,也不能说明;各种组分的浓度不再发生变化,但各种组分的浓度不一定相等,③不正确;④正确,⑤中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;密度是混合气的质量和容器容积的比值,在反应过程乙中质量和容积始终是不变的,⑥不正确;⑦中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此⑦中的关系始终是成立,不正确,所以正确的答案选D。
点评:该题是中等难度的试题,该题也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,如何结合具体的可逆反应灵活运用即可。
本题难度:简单
4、选择题 X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y?2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.35%
B.40%
C.50%
D.65%
参考答案:假设X和Y物质的量为1mol,达平衡时消耗Y物质的量为m,依
本题解析:
本题难度:一般
5、选择题 反应2Z(g)===X(g)+ Y(g) ,△H>0.达到平衡时,下列说法正确的是(???)
A.加入催化剂,X的产率增大
B.升高温度,Y的转化率增大
C.当容器活塞可活动时,充入稀有气体,平衡不移动
D.充入Z气体时,Z的转化率增大
参考答案:B
本题解析:A选项中加入催化剂,不影响化学平衡;B选项中升高温度,平衡向吸热方向移动,而该反应为吸热反应,所以平衡向正方向移动,故Y的转化率增大;C选项中由于容器活塞可移动,当充入稀有气体时,体积增大,反应物浓度减小,故平衡发生移动;D选项中充入Z气体时虽然能使平衡向正反向移动,有助于提供反应物的转化率,但充入的是Z气体,故其转化率降低。
本题难度:一般