微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol C(金刚石)中含有C—C键的数目为4NA
B.标准状况下,22.4L乙烯中含有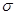 键的数目为5NA
键的数目为5NA
C.含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA
D.电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA
参考答案:B
本题解析:
试题分析:金刚石中每个C-C键被两个C原子共有,每个C原子能形成4各共价键,所以1mol金刚石含有C-C的数目为2NA;C项随反应的进行,硫酸浓度减小,而稀硫酸不与铜反应,所以提供0.2molH2SO4,并不能全部反应,而生成的SO2也小于0.1NA;D选项解析因为阳极含有杂质有比铜活泼的还有比铜稳定的每减少32g金属转移电子数无法判断可能大于NA也可能小于NA,错误
考点:阿伏伽德罗常数。
本题难度:一般
2、计算题 (6分)准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL某浓度的HCl溶液中(SiO2不溶于HCl溶液),充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的质量m与加入NaOH溶液的体积的关系如图所示
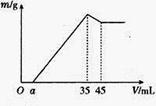
求:
(1)原溶液中c(HCl)= mol/L。
(2)若a=2.6mL,计算各组分的质量:m(Al2O3)= g;m(SiO2)= g。
参考答案:(1)3.5 mol/L
(2)m(Al2O3)=5.
本题解析:
试题分析:(1)沉淀量最大时,生成沉淀是Al(OH)3、Fe(OH)3;溶液中只有氯化钠,氯化钠中钠离子来自氢氧化钠,氯离子来自盐酸.即加入OH- 物质的量与溶液中H+物质的量相等。c(HCl) =3.5mol/L
(2)根据沉淀减小变化,发生反应:
Al(OH)3+NaOH=NaAlO2+2H2O
1mol 1mol
y (0.045-0.035)*10
y=0.1mol
铝元素守恒,则n(Al2O3)=0.05mol、m(Al2O3)=0.05*102=5.1g
a=2.3时溶液中溶质只有氯化钠,氯化铝,氯化铁
n(Fe3+)×3+n(Al3+)×3+n(Na+)="n(Cl)" (电荷守恒)
n(Fe3+)×3+0.05×2×3+0.0023×10=3.5×0.1
n(Fe3+)=0.009mol
m(Fe2O3)=0.009/2×160=0.72g
考点:考查混合物的有关计算
本题难度:一般
3、选择题 下列溶液中的氯离子浓度为0.3mol
参考答案:
本题解析:
本题难度:一般
4、选择题 将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8?mol,这些气体恰好能被500?mL?2?mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
A.0.2 mol
B.0.4 mol
C.0.6 mol
D.0.8 mol
参考答案:A
本题解析:
试题分析:51.2gCu的物质的量=51.2g÷64g/mol=0.8mol,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,则铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2。其中氮元素的化合价从+5价降低到+3价,所以根据得失电子数目相等得到n(Cu)=n(NaNO2),因此n(NaNO2)=n(Cu)=0.8mol。氢氧化钠的物质的量=0.5L×2mol/L=1.0mol,则根据钠离子守恒可知,硝酸钠的物质的量=1.0mol-0.8mol
本题难度:一般
5、选择题 设NA代表阿伏加德罗常数,下列说法不正确的是?
A.阿伏加德罗常数NA是0.012kg12C中所含的原子数
B.2g氢气所含氢原子数目为NA
C.标况下,22.4L NH3所含的分子数目为NA
D.1 L 1 mo1·L-1NaCl溶液中所含有的Na+离子数目为NA
参考答案:B
本题解析:B项,2g氢气相当于1mol氢气,所含氢原子数目为2NA,B项错误
本题难度:一般