微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (7分) t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= 。
3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 。
参考答案:(1)10-12 (2)1
本题解析:(1)稀溶液中氢离子和OH-的浓度之积是水的离子积,所以kw=c(H+)·c(OH-)=10-a·10-b=10-a-b=10-12。
(2)根据数据可判断氢氧化钠是过量的,所以反应后c(OH-)=
 则c(H+)=
则c(H+)= ,所以pH=11。
,所以pH=11。
(3)混合后溶液呈中性,则氢离子的物质的量和OH-的物质的量相等,即 ,解得a+b=14。
,解得a+b=14。
(4)若HA是强酸,则二者恰好反应,溶液显中性。混合溶液的pH=5,说明溶液显酸性,因此HA一定是弱酸,即反应后HA是过量的,所以溶液才能显酸性。
本题难度:一般
2、选择题 在KHSO4的水溶液及熔化两种状态下都能存在的离子是
A.K+
B.H+
C.HSO4-
D.SO42-
参考答案:A
本题解析:物质熔化可破坏离子键,但不能破坏共价键,在水溶液中,可破坏离子键也可破坏强极性共价键。KHSO4熔化电离:KHSO4 K++ HSO4-?,水溶液电离:KHSO4
K++ HSO4-?,水溶液电离:KHSO4![]() K++H++ SO42-。
K++H++ SO42-。
本题难度:困难
3、实验题 (10分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol?L-1的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol?L-1的盐酸溶液。
(1)写出实验过程中第一次滴定①-④的编号顺序______________。
(2)下图所示的仪器中配制0.1mol?L-1盐酸和0.1mol?L-1氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。
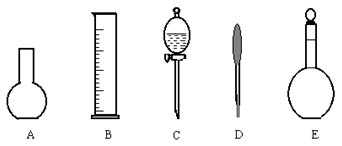
(3)配制上述溶液应选用的容量瓶的规格是(重复滴定一次)__________________。
A.50mL、50mL
B.100mL、100mL
C.100mL、150mL
D.250mL、250mL
(4)写出有关的化学方程式_____________________ 。
参考答案:(1)①②④③(或②①④③)。(2)A、C;玻璃棒、烧杯。(
本题解析:
试题分析:(1)首先配制需要的标准浓度的溶液,取待测物制成溶液,在待测物溶液中加入一定量的盐酸,再用氢氧化钠进行滴定,所以顺序为:①②④③(或②①④③)。(2)配制溶液需要容量瓶,量筒,胶头滴管,烧杯,玻璃棒,不需要平底烧瓶和分液漏斗,所以选A、C;图上还缺少玻璃棒、烧杯。(3)因为每次实验至少使用25毫升溶液,两次就需要50毫升,所以至少需要配制溶液各100毫升,选B。(4)过程中涉及了碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,盐酸和氢氧化钠反应生成氯化钠和水,所以方程式为:(4)CaCO3+2HCl=CaCl2+CO2+H2O HCl+NaOH=NaCl+H2O
考点:酸碱中和滴定。
本题难度:一般
4、实验题 阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ;
②该滴定操作中应选用的指示剂是 ;
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用_____ _的NaOH溶液,原因是______________ ________。
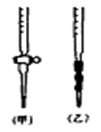
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位) 。
参考答案:(1)①ECDBAGF;②酚酞;③无色变为浅红色(或粉红色)
本题解析:(1)考查中和滴定的实验操作
①正确的顺序为ECDBAGF
②强碱滴定强酸,终点时溶液显中性,所以选择酚酞作指示剂。
③当溶液中出现无色变为浅红色(或粉红色)且半分钟不褪去时,反应即达到滴定终点。
(2)碱式滴定管未用标准液润洗,相当于稀释了氢氧化钠,消耗氢氧化钠溶液的体积增加,所以测定结果偏高。
(3)准确配制一定物质的量浓度的溶液所需要的主要仪器是100.00mL容量瓶。
(4)溶液浓度越小,反应越慢,消耗的溶液体积越大,误差越小。
(5)乙是碱式滴定管,氢氧化钠应该注入乙中。
(6)滴定前仰视,则读数偏大。滴定后俯视,则读数偏小,所以消耗的氢氧化钠溶液体积偏小,测定结果偏低。
(7)硫酸是二元酸,所以硫酸的浓度是0.015L×0.14mol/L÷0.025L×2=0.042mol/L。因此最初硫酸的浓度是0.042mol/L×100=4.20mol/L.
本题难度:一般
5、填空题 (8分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(按照要求用 a、 b 、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是________________。
(4)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(5)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________。
(6)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是_________
(7)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_________________。
参考答案:21、(1)b>a >c ; (2) b>
本题解析:
试题分析:①氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c;
②同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c;
③氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c,氢离子浓度越大,水的电离程度越小,三种溶液中水的电离程度由大到小的顺序是c >a > b;
④氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,物质的量浓度由大到小的顺序为c>a>b;
⑤氯化氢和硫酸是强电解质,完全电离,醋酸是弱电解质部分电离,当三者c(H+)相同时,醋酸的浓度大于盐酸,所以当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积醋酸最多,由大到小的顺序是c >a = b
⑥与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c,;随着反应的进行,弱酸继续电离,化学反应速率加快,若产生相同体积的H2,反应所需时间短,反应所需时间的长短关系是a =" b" < c;
⑦强酸溶液稀释100倍,氢离子浓度变为原来的1/100,,弱酸溶液稀释10倍,氢离子浓度变为大于原来的1/100,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b。
考点:考查弱电解质的电离,化学反应速率,溶液的稀释,PH值等知识。
本题难度:一般