微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。
(1)三硅酸镁的氧化物形式为____________,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为____________。
(2)铝元素的原子核外共有________种不同运动状态的电子、__________种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径________(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
________________________
(4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是____________。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
参考答案:(1)2MgO·3SiO2·nH2O;1s22s1;
本题解析:
本题难度:一般
2、实验题 为了检验市场上常见两种金属饮料瓶的主要成分,某小组取甲、乙两种饮料瓶,将其剪碎作为样品,分别按下述步骤进行实验:
I.取少量样品于试管中,加入盐酸,充分反应后过滤。
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液。
步骤II的实验现象如下:
样品甲
| 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失
|
样品乙
| 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色
?
(1)样品甲中金属的主要成分是?????????,生成白色沉淀反应的离子方程式是????????????????。
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是???????,白色沉淀变为红褐色反应的化学方程式是???????????????????????????????????????????。
参考答案:(1)Al?? Al3++3OH—="=" Al(OH)3↓
本题解析:
试题分析:样品甲:2Al+6HCl=2AlCl3+3H2↑. AlCl3+3NaOH= Al(OH)3↓+3NaCl. Al(OH)3+OH-=AlO2-+ H2O;
样品乙: Fe+2HCl=FeCl2+H2↑. FeCl2+2NaOH= Fe(OH)2↓+3NaCl, 4Fe(OH)2 + O2+2H2O == 4Fe(OH)3
故样品甲中金属的主要成分是是铝,生成白色沉淀反应的离子方程式是Al3++3OH—="=" Al(OH)3↓(2)样品乙进行步骤I后所得滤液中一定含有的金属
本题难度:一般
3、选择题 把4.6 g钠放入100 mL 0.1 mol/L AlCl3溶液中,待其充分反应后(水蒸发不计),下列叙述中错误的是(??)
A.Cl-浓度不变
B.溶液仍有浑浊
C.溶液中几乎不存在Al3+
D.溶液中存在最多的离子是Na+
参考答案:B
本题解析:4.6 g钠的物质的量为0.2 mol,与水反应生成0.2 mol NaOH。100 mL 0.1 mol/L AlCl3溶液中Al3+的物质的量为0.01 mol,Cl-的物质的量为
0.03 mol。n(Al3+)∶n(OH-)="0.01" mol∶0.2 mol=1∶20,根据Al3++4OH-= 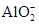
本题难度:一般
4、选择题 下列有关金属铝及其化合物的叙述正确的是?????????????????????(??)
A.铝是比较活泼的金属,所以很容易被腐蚀
B.铝在常温下不能与冷的浓硫酸和浓硝酸反应
C.氧化铝只能与酸反应,不能与碱反应
D.氢氧化铝既能溶于酸又能溶于碱是因为其存在酸式和碱式两种电离
参考答案:D
本题解析:铝是一种较活泼金属单质,在常温可以与空气中的氧气反应生成一层致密的氧化物薄膜附着在金属表面,起保护作用;铝在常温下被浓硫酸和浓硝酸钝化,是在铝的表面生成致密的氧化物薄膜从而阻止了反应的继续进行;氧化铝是两性化合物,与酸碱均能反应。
本题难度:简单
5、选择题 13.5g金属铝与1L 2mol?L-1 NaOH溶液充分反应,生成的气体在标准状况下的体积为( ???)
A.11.2L
B.22.4L
C.33.6L
D.44.8L
参考答案:C
本题解析:2Al+2NaOH→3H2;0.5mol铝与2mol氢氧化钠反应,氢氧化钠过量,生成0.75mol氢气,体积为33.6L
本题难度:简单
|