微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:Cu+2Fe3+═2Fe2++Cu2+.现把相同物质的量的CuSO4、FeCl3和Zn置于水中充分反应,反应所得混合物中除含有SO42-和Cl-外,还含有
A.Zn2+、Cu、Fe3+
B.Zn、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe2+
D.Zn2+、Cu、Cu2+、Fe2+
参考答案:D
本题解析:分析:根据金属活动性反应的先后顺序:在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,所以,先是Zn与FeCl3反应,接着是Zn与CuSO4反应,据此即可解答.
解答:把相同物质的量的CuSO4、FeCl3和Zn置于水中充分反应,设它们的物质的量都为1mol,根据反应顺序判断:
先是? Zn+2FeCl3=ZnCl2+2FeCl2,Zn+CuSO4 =ZnSO4 +Cu
??? 0.5mol??? 1mol???????????????? 0.5mol???0.5mol????
剩余0.5molZn,剩余0.5molCuSO4,生成??0.5molCu,
反应所得混合物中除含有SO42-和Cl-外,还含有Zn2+、Cu、Cu2+、Fe2+,
故选:D.
点评:本题考查了金属活动性顺序的应用,依据金属活动性顺序的意义进行解答是关键,题目较简单.
本题难度:困难
2、选择题 镁和铝都是较活泼金属,下列叙述不正确的是
①镁易溶于冷水,而铝难溶于冷水②镁溶于碱液,而铝难溶于碱液③常温下镁难溶于浓硫酸,而铝易溶于浓硫酸
A.①
B.②
C.③
D.全部
参考答案:D
本题解析:镁不易溶于冷水,可和沸水反应生成氢氧化镁和氢气,镁不溶于碱液,而铝易溶于碱液生成偏铝酸盐和氢气,常温下镁易溶于浓硫酸,而铝于浓硫酸纯化不易溶解。
本题难度:一般
3、选择题 某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中无沉淀生成,则X是?????? ( )。
A.SiO2
B.Al2O3
C.MgO
D.CuO
参考答案:B
本题解析:C项MgO不能溶于烧碱,不正确;少量Y滴入盐酸不能形成沉淀,Al2O3符合题意,A项不正确;B项正确;D项CuO不能溶于烧碱,不正确。
本题难度:一般
4、填空题 某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| 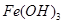
| 
| 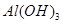
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
?
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧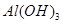 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________,步骤⑤反应的离子方程式是_______________________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:
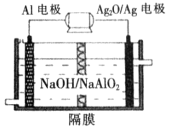
请写出该电池正极反应式_________________;常温下,用该化学电源和惰性电极电解300mL氯化钠溶液(过量),消耗27mg Al,则电解后溶液的pH=_________(不考虑溶液体积的变化)。
(6)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中,钢材为________极;镀铝后能防止钢材腐蚀,其原因是____________________________________。
参考答案:(1)Cu、Fe、SiO2(2分)
(2)坩埚(1分)
本题解析:
试题分析:该工艺流程原理为:铝矿加入硫酸,溶解氧化铜、氧化铝,加入过量铁粉,除去溶液中铜离子,过滤,滤渣中主要为Cu、Fe、SiO2,滤液X中含有铝离子、亚铁离子,再加入过氧化氢,将亚铁离子氧化为铁离子,通过调节pH值,使铁离子转化为氢氧化铁而除去,溶液Y含有铝离子,加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝生成金属铝。(1)滤渣主要成分的 化学式为:Cu、Fe、SiO2。(2)灼烧固体时,要用到坩埚。(3)沉淀Al3+的试剂为氨水,步骤⑤反应的离子方程式是:Al3++3NH
本题难度:困难
5、填空题 工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下:
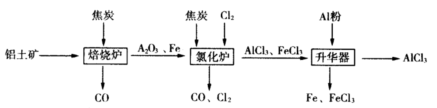
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol 2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。 4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为?????????。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的???????(填字母序号)。
①氧化性? ②吸水性? ③难挥发性? ④脱水性
a.只有①??? b.只有②??? c.只有②③??? d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
参考答案:(1)-467.5
(2)①3?? Cl2+SO32-
本题解析:(1)由①+②得所求方程式,所以△H=-467.5kJ·mol
(2)① 由2Al2O3+3Cl2+3C=2AlCl3+3CO知,生成2molAlCl3转移电子数为6,则1mol AlCl3时转移3mol电子;根据题意得:Cl2+SO32-+H2O=2Cl-+SO42-+2H+;Al+FeCl3=Fe+AlCl3由于AlCl3升华而FeCl3不升华,温度在应315℃以下。
②此处只用到吸水性,难挥发性。
(3)氧气在中性溶液中正极反应:O2+4e-+2H2O=4OH-;设都放出6mole
本题难度:一般
|