微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在标准状况下进行下列实验:甲、乙各取?30.0ml同浓度的盐酸,加入同一镁-铝合金粉末产生气体,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙
合金质量/mg
255
385
510
气体体积/ml
280
336
336
(1)盐酸的物质的量浓度为______?mol/L,在表中可作为计算依据的是______?(填实验序号来源:91考试网 www.91exAm.org,符合要求的全部写出)
(2)据______(填实验序号)中的数据,可计算此镁-铝合金中镁与铝的物质的量之比______.
(3)在乙实验中,可以判断______
A、金属过量???B、恰好反应???C、金属不足????D、无法判断
(4)在丙实验之后,向容器中加入一定量的1.00mol/l的NaOH溶液能使合金中的铝粉恰好完全溶解,再过滤出不溶性的固体,请填下表:
| 滤液中的溶质 | NaCl | NaAlO2
对应物质的量/mol
加入NaOH溶液的体积/ml |
2、选择题 下列说法不正确的是
A.用坩埚钳夹住一小块铝箔在酒精灯上加热到熔化,但熔化的铝并不滴落,是因为铝表面生成了熔点更高的氧化铝。
B.铜属于重金属,它的化学性质不活泼,铜盐有毒,能使蛋白质失去活性,故误食铜盐后,应立即服用牛奶或蛋清急救再送医院治疗。
C.盐桥中通常装有琼脂的KCl溶液,形成如图所示原电池的闭合回路时,氯离子向正极移动,钾离子向负极移动。
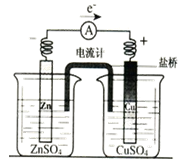
D.水的电离是吸热反应,升高温度,促进水的电离,水的离子积常数Kw变大。
3、选择题 关于镁、铝的叙述中不正确的是(?????)
A.铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气
B.镁铝合金的强度和硬度都比纯铝和纯镁大
C.在高温下,可以用铝制的容器装运浓硫酸或浓硝酸
D.常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而失去光泽
4、计算题 将等物质的量的两种氧化物溶于100 mL硫酸,而后逐滴加入1.00 mol·L-1的NaOH溶液。当加入的NaOH的体积V1="50" mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2="650" mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750 mL时,沉淀量不再改变。
(1)最初加入的50 mL NaOH溶液的作用是什么?
答:__________________________________________。
(2)画出沉淀量(m)随NaOH溶液体积滴入量的变化关系,并计算所用硫酸的浓度。
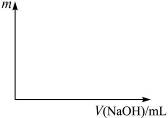
图4-5
(3)试判断两种氧化物各是什么,并计算其物质的量。
5、填空题 某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4·5H2O晶体和AlCl3
溶液:
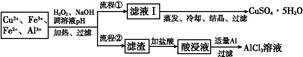
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
离子
| Fe3+
| Fe2+
| Al3+
| Cu2+
| pH范围
| 2.2~3.2
| 5.5~9.0
| 4.1~5.0
| 5.3~6.6
请回答下列问题:
(1)加入H2O2的作用是 ??????????????????????????????????,欲使制取的CuSO4·5H2O晶体较为纯净,pH至少应调至 。
(2)写出H2O2与Fe2+反应的离子方程式:??????????????????????????????????????。
(3)流程②中加入适量Al粉起的作用是?????????????????????? 。
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3 (填“能”或“不能”),原因是 ????????。
(5)取体积为V(L)的酸浸液,向其中滴加a mol·L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图。请用V1、V2、V3表示所取的酸浸液中n(Fe3+)∶n(Al3+)= ???????????????????。

|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772