微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
B.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
C.Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D.向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
参考答案:A
本题解析:
试题分析:在书写离子方程式时,强酸强碱和可溶性盐写成离子形式。B中Cu和稀硝酸反应应该生成NO,
故B错误;C选项配平错误。D中的铁离子具有强氧化性,可以把I-氧化,应该写作2Fe(OH)3+6H+ +2I-
==2Fe2+ +I2+6H2O故D也错误
考点:考查离子方程式书写等相关知识点
本题难度:困难
2、选择题 下列离子方程式改写成化学方程式正确的是
A.Cu2+ +2OH- =Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3
B.CO32- + 2H+ = CO2 + H2O BaCO3 + 2HCl =BaCl2+ CO2 + H2O
C.Ca2+ + CO32- = CaCO3 Ca(NO3)2+NaCO3 = CaCO3+NaNO3
D.H+ +OH- = H2O 2KOH+H2SO4 = K2SO4 +2H2O
参考答案:D
本题解析:
试题分析:Cu2+ +2OH- =Cu(OH)2 Cu2+选择可溶性的盐,CuCO3+2NaOH=Cu(OH)2+Na2CO3,CuCO3难溶,A错误;CO32- + 2H+ = CO2 + H2O CO32-选择可溶性的碳酸盐,BaCO3 + 2HCl =BaCl2+ CO2 + H2O,BaCO3难溶,B错误; Ca(NO3)2+NaCO3 = CaCO3+NaNO3碳酸钠的化学式错误,C错误;H+ +OH- = H2O 2KOH+H2SO4 = K2SO4 +2H2O D正确。
考点:考查化学方程式的书写。
本题难度:一般
3、选择题 下列反应的离子方程式不正确的是
A.氯化钡和稀硫酸反应:Ba2++SO42- = BaSO4 ↓
B.铁与稀盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.锌与硫酸铜溶液反应:Zn+Cu2+ = Zn2++Cu
D.氢氧化钠和盐酸反应:OH-+ H+ = H2O
参考答案:B
本题解析:
试题分析:铁与稀盐酸反应的离子方程式为:Fe + 2H+ = 2Fe2+ + H2↑,故B错误,答案选B。
考点:考查离子方程式的正误判断。
本题难度:一般
4、选择题 下列离子方程式正确的是
A.氯化镁溶液中滴入NaOH溶液:MgCl2 + 2OH—
参考答案:
本题解析:
本题难度:一般
5、填空题 (14分)钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
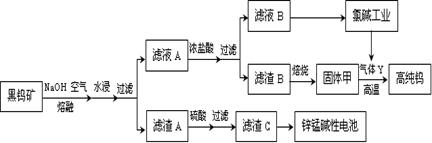
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
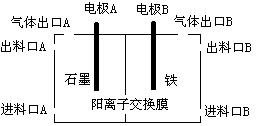
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
参考答案:(14分)
⑴ 氧化Fe2+、Mn2+(2分)
本题解析:
试题分析:(1)因为锌锰碱性电池中含有二氧化锰,所以通入空气的目的是氧化Fe2+、Mn2+,使其转化为Fe3+、Mn4+;
(2)因为亚铁离子被氧化为铁离子,与氢氧化钠反应生成氢氧化铁沉淀,在加热条件下,最终转化为氧化铁或四氧化三铁,所以滤渣A与稀硫酸反应实质是氧化铁与稀硫酸反应,离子方程式是Fe2O3 + 6H+= 2Fe3+ + 3H2O 或 Fe3O4 + 8H+= 2Fe3++ Fe2++ 4H2O;
(3)碱性锌锰电池的Zn发生氧化反应,作原电池的负极,滤液A与盐酸反应生成钨酸沉淀,焙烧分解生成WO3,氯碱工业中产生的气体有氢气和氯气,而氢气可还原WO3为W,氢气在负极产生,而Fe不能做阳极,所以Fe极为阴极,所以锌锰碱性电池的锌电极应与装置中电极B相连,则氢气在B口出来的气体;为增强溶液的导电性,在进料口B处加入稀NaOH溶液;碱性锌锰电池的正极发生还原反应,二氧化锰得到电子生成MnOOH,电极反应式为MnO2 + e-+ H2O =" MnOOH" + OH-;
(4)若用碳单质还原WO3,则W中可能含有C单质,而用氢气还原,则不会产生杂质;
(5)利用盖斯定律将氧气消去,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的反应热ΔH=4ΔH2-ΔH1=-252.9kJ/mol,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的的热化学方程式是CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH=-252.9kJ/mol。
考点:考查工业流程的分析,电化学反应原理的应用,盖斯定律的应用
本题难度:困难