微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:??????????????。
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
①A的化学式是?????????????B的化学式是????????????。
②原白色粉末中一定含有???????????????????,可能含有????????????,
对可能含有的物质,可通过????????????(填实验名称)进一步检验。检验操作步骤有:①蘸取待测液;②置于酒精灯火焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝。其中正确的操作顺序为??????????。
A.①②③④?????? B.④①②③??? C.④②①②③④???? D.①③②④
参考答案:
(1)K2O·Al2O3·6SiO2
(2)①
本题解析:
试题分析:(1)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO?nSiO2?mH2O),所以KAlSi3O8可表示为:K2O?Al2O3?6SiO2,(2)①FeCl3溶液为棕黄色,将白色粉末加水溶解,得无色溶液,所以一定不含有FeCl3,K2SO4和BaCl2会发生沉淀反应K2SO4+BaCl2 =BaSO4↓+2KCl.而不能大量共存。所以二者至多有一种。向①中所得的无色溶液中加入NaOH溶液并加热,仅观察到有白色沉淀A生成,则一定含有碳酸氢钠和氯化钡,就不含有K2SO4。NaHCO3+NaOH= Na2CO3+ H2O,Na2CO3+ BaCl2=BaCO3↓+2NaCl。过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,则该白色沉淀为氯化银。 有白色沉淀A生成,则还是证明溶液中含有碳酸氢钠和氯化钡。氯离子可能是氯化钡电离产生,也可能是KCl电离产生。因此不能确定是否含有KCl。钾离子的检验,可通过焰色反应检验,焰色反应的操作步骤:④用稀盐酸洗净铂丝,②置酒精灯火焰上灼烧,①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察火焰颜色,④用稀盐酸洗净铂丝,故正确选项为C。
本题难度:一般
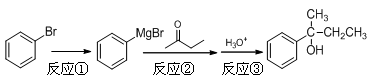
2、实验题 2-苯基-2-丁醇是重要的有机合成中间体,以溴苯为原料合成该中间体的反应原理如下:
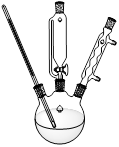
【实验装置】
 ??????
??????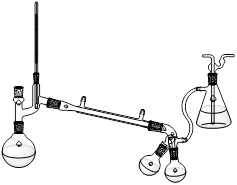
装置Ⅰ??????????????????????????装置Ⅱ
【实验步骤】
步骤1:将镁条置于装置Ⅰ的三颈烧瓶中,加入100 mL乙醚(ρ=0.71g·cm-3),在冷却条件下缓缓滴入溴苯,微热并加入一小块碘引发反应①。
步骤2:滴加14.2 mL丁酮和30 mL乙醚混合物,发生反应②;滴加入20%的NH4Cl水溶液,发生反应③。
步骤3:分出油层,用水洗涤至中性,用无水CaCl2干燥。
步骤4:用装置Ⅱ先蒸出乙醚,再蒸馏出产品。
⑴步骤1中加入碘的作用是?????。
⑵装置Ⅰ中滴加液体所用的仪器的名称是?????,反应②需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,其目的是?????。
⑶步骤三中分离出油层的具体实验操作是?????。
⑷装置Ⅱ采用的是减压蒸馏,实验时需将吸滤瓶需连接?????;采用这种蒸馏方式的原因是?????。
参考答案:
⑴做催化剂
⑵恒压漏斗 ?????该反应放热,
本题解析:
试题分析:(1)加入一小块碘“引发”反应,碘为催化剂;(2)置于冰水中温度低,逐滴加入控制反应速率,故防止反应速率过快;(3)分液分离油层,将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中;(4)减压蒸馏能降低沸腾时温度,防止温度过高引起物质分解等问题。
本题难度:一般
3、选择题 某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
A.一定有Cl-
B.一定有SO42-
C.一定没有Al3+
D.一定没有CO32-
参考答案:BD
本题解析:
试题分析:将溶液滴在蓝色石蕊试纸上,试纸变红,说明溶液显酸性,因此一定没有CO32-。滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,白色沉淀是硫酸钡,一定有SO42-;在上层清液中滴加硝酸银溶液,产生白色沉淀,白色沉淀是氯化银,但由于前面加入了氯化钡溶液,引入了氯离子,因此不能确定原溶液中是否含有 氯离子。根据溶液的电中性可知Na+、Al3+至少有一种,所以正确的答案选BD。
本题难度:一般
4、选择题 下列除去杂质的方法正确的是
① 除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液,洗气;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③ 除去CO2中少量的CO:在空气中点燃;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①②
B.②④
C.③④
D.②③
参考答案:B
本题解析:① 错,除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液除去乙烯的同时又引入新的杂质二氧化碳气体,正确方法为通入溴水;③错 CO2中少量的CO在空气不能点燃,正确的方法为通过灼热的氧化铜;
本题难度:一般
5、选择题 下列可以用来鉴别SO2和CO2的方法是
①通入紫色石蕊试液中?②闻气味??③通入澄清石灰水中???④通入品红溶液中
⑤通入氯水中,再滴加Ba(NO3)2溶液。
A.①②
B.②③
C.②④⑤
D.③④
参考答案:C
本题解析:二者都是酸性氧化物,都能使澄清的石灰水变混浊,其水溶液也能使紫色石蕊试液显红色。但SO2是具有刺激性气味的还原性气体,而且还具有漂泊性,能使品红溶液褪色,所以正确的答案是C。
本题难度:简单