微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是
A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量
B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ
C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量
D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量
参考答案:D
本题解析:
试题分析:A、根据题给热化学方程式知,2mol(g)和1mol O2(g)完全反应生成2mol H2O(g),放热270kJ,则逆反应吸热270kJ,2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量,正确;B、2mol(g)和1mol O2(g)完全反应生成2mol H2O(g),放热270kJ,气态水变化为液体放热,2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ,正确;C、反应是放热反应,反应物能量总和大于生成物能量总和,故2mol氢气与1mol氧气的能量
本题难度:一般
2、选择题 实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)外,所用的其他仪器和试剂均正确的一组是(? )
A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个
B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个
C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个
参考答案:D
本题解析:为了减少热量散失,HCl和NaOH应有一方过量,取HCl和NaOH溶液不能用同一个量筒。
本题难度:一般
3、选择题 一个化学反应一般都有旧化学键的破坏和新化学键的形成.在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催
化剂的反应历程),下列叙述正确的是
①使用催化剂可降低生产能耗
②该反应的热化学方程式为N2(g)+3H2(g)?

2NH3(g)+92kJ
③相同状况下,lmol氮气和3mol氢气总能量高于2mol氨气的总能量
4相同状况下,lmol氮气和3mol氢气总键能低于2mol氨气的总键能( )
A.①②③④
B.只有②③④
C.只有①②③
D.只有②③

参考答案:①催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降
本题解析:
本题难度:简单
4、选择题 下列变化属于吸热反应的是
①用镁条引燃铝、氧化铁混合粉末???②碳酸钙受热分解???③浓硫酸稀释?
④氢氧化钡晶体和氯化铵固体反应???⑤生石灰和水反应
A.②④
B.①④
C.②③
D.①⑤
参考答案:A
本题解析:①③⑤放热反应,②④吸热反应,强酸强碱溶于水放热,铝热反应放出大量的热。
本题难度:一般
5、实验题 实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验次数
| 起始温度t1/℃
| 终止温度t2/℃
|
盐酸
| NaOH溶液
|
1
| 20.2
| 20.3
| 23.7
|
2
| 20.3
| 20.5
| 23.8
|
3
| 21.5
| 21.6
| 24.9
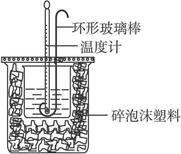
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_____________________________________,
不能用铜丝搅拌棒代替环形玻璃棒的理由是__________________________________。
(2)经数据处理,t2-t1="3.4" ℃。则该实验测得的中和热ΔH=_________〔盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算〕。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1_________ΔH(填“<”“>”或“=”=,理由是________________________。
参考答案:(1)上下搅动(或轻轻搅动)? Cu传热快,防止热量损失
本题解析:(1)对于本实验,让氢氧化钠和盐酸尽可能地完全反应是减小误差的一个方面,所以实验时用环形玻璃棒上下搅动,以防将温度计损坏。做好保温工作是减小误差的另一个重要方面。所以选用玻璃棒,而不用铜丝。
(2)ΔH=-[100 g×4.18×10-3kJ·( g·℃)-1×3.4 ℃]÷0.025 mol="-56.8" kJ·mol-1
(3)因弱电解质的电离过程是吸热的,将NaOH溶液改为相同体积、相同浓度的氨水反应后放出的热量少,所以ΔH1>ΔH。
本题难度:一般
|