微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,可逆反应N2+3H2?2NH3 △H=-92.4KJ/mol,有关该反应的叙述正确的是( )
A.正催化剂能加快正反应速率v正,不影响v逆,所以缩短了反应达平衡所需的时间
B.将lmolN2和3molH2充分反应达到平衡时,放出的热量等于92.4kJ
C.当c(N2):c(H2):c(NH3)=1:3:2时,反应就达到平衡状态
D.平衡时增大氮气的浓度,达新平衡时N2转化率减小,H2转化率增大
参考答案:A.正催化剂能同等程度的增大正逆反应速率,缩短反应到达平衡的
本题解析:
本题难度:一般
2、选择题 在一个密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是??????????????
2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是??????????????
A.SO2为0.4mol/L,O2为0.2mol/L
B.SO3(g)为0.4mol/L
C.SO2、SO3(g)均为0.15mol/L
D.SO2为0.25mol/L
参考答案:D
本题解析:可采用极值法。若全部转化为生成物,则SO3的浓度是0.4mol/L。若全部转化为反应物则SO2、O2的浓度分别为0.4mol/L、0.2mol/L。因为是可逆反应,所以选项A、B不可能。由硫原子守恒可知,SO2和SO3的浓度之和应满足0.4mol/L,即C也不可能。答案是D。
本题难度:简单
3、填空题 (10分)设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  ?FeO(s)+H2(g)的平衡常数为K2,在不同温度下,?K1、K2的值如下:
?FeO(s)+H2(g)的平衡常数为K2,在不同温度下,?K1、K2的值如下:
T(K)
| K1
| K2
|
973
| 1.47
| 2.36
|
1173
| 2.15
| 1.67
?
( 1)平衡常数K1的表达式为??????????________________ ???。
(2)现有反应③ CO2(g) +H2(g)  ?CO(g) +H2O(g);△H>0,这是一个???????????(填“吸”或“放”)?????热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有????????????。 ?CO(g) +H2O(g);△H>0,这是一个???????????(填“吸”或“放”)?????热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有????????????。
A.缩小反应容器容积??????? B.扩大反应容器容积?????? C.降低温度
D.升高温度??????????????? E.使用合适的催化剂??????? F.设法减少CO的量
(3)若反应Fe(s)+CO2(g)  ?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g) ?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  ?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率?????????(填序号)。 ?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率?????????(填序号)。
A.前者大?????????? B.后者大????????? C.一样大??????? D.无法判断
(4)以下图像:(图中v为速率,φ为生成物的百分含量,T为温度)
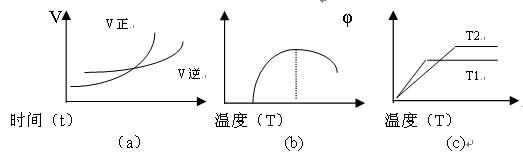
其中符合反应①的是?? _________?(填图像序号,下同),符合反应②的是?? ___???。
参考答案:
(1)K1=c(CO)/
本题解析:略
本题难度:简单
4、选择题 在一定温度下,反应A2(s)+2B2(g)  ?2AB2(g)达到平衡的标志是 [???? ] ?2AB2(g)达到平衡的标志是 [???? ]
A.一段时间内A2:B2:AB2的平均化学反应速率之比为1:2:2
B.单位时间内生成n mol A2的同时生成2n mol的AB2
C.反应混合物中A2、B2、AB2三种物质的物质的量浓度之比为1:2:2
D.容器内的总压强不随时间变化
参考答案:B
本题解析:
本题难度:一般
5、填空题 能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
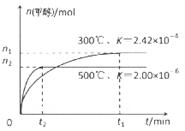
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。 CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。 CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
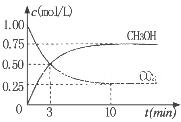
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)="_______" ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  ?CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH??的平衡转化率为______ 。 ?CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH??的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。

参考答案:(1)<温度升高,平衡时甲醇的量减少,平衡逆向移动,则正反应
本题解析:
试题分析:(1)当反应达到平衡后,由于升高温度,n(CH3OH)减小,平衡时CH3OH的含量降低,说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。逆反应方向是吸热反应,所以正反应是放热反应。故△H<0.(2) ①由图一可知:CO2(g)+H2(g)=CO(g)+H2O(l)?△H="41KJ/mol," 由图二可知:CO(g)+2H2(g)  本题难度:困难 本题难度:困难
|