微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于可逆反应:mA(s)+ nB(g)="==" eC(g)+ f D(g),反应过程中,不同温度(T1、T2)或不同压强(P1、P2)时,反应混合物中B的体积分数[ψ(B)]与时间(t)的关系曲线如下图所示(假设反应开始时只有A和B):

下列有关叙述中正确的是????????????????????????????????????????????????????????????????????????????????(???)
A.使用适宜的催化剂,C的体积分数将增大
B.反应方程式中化学计量数的关系是m + n >e + f
C.升高温度,平衡将向逆反应方向移动
D.A的颗粒越小,越有利于平衡向正反应方向移动
参考答案:C
本题解析:略
本题难度:简单
2、选择题 在相同温度和压强下,对反应CO2(g)+H2(g)=CO(g)+H2O (g)进行甲、乙、丙、丁四组实验,,实验起始时放入容器内各组分的物质的量见下表
物质的量
| CO2
| H2
| CO
| H2O
|
甲
| a mol
| a mol
| 0 mol
| 0 mol
|
乙
| 2a mol
| a mol
| 0 mol
| 0 mol
|
丙
| 0 mol
| 0 mol
| a mol
| a mol
|
丁
| a mol
| 0 mol
| a mol
| a mol
?
上述四种情况达到平衡后,n(CO)的大小顺序是(???)
A.乙=丁>丙=甲?? B.乙>丁>甲>丙?? C.丁>乙>丙=甲? D.丁>丙>乙>甲
参考答案:A
本题解析:此题可根据等效平衡理论,将产物按化学计量数转化到的反应物一边,只要与原平衡对应物质的物质的量完全相同,所建立的平衡与原平衡视为等效。通过转换关系计算发现,甲与丙相同,乙和丁相同,甲:n(CO2)=n(H2)=a,乙:n(CO2)=2a,n(H2)=a,乙建立的平衡可以看成甲建立平衡后再加入amol甲,乙平衡向正反应移动程度大于甲,故n(CO)的大小顺序是乙=丁>丙=甲,答案选A。
点评:因等效平衡问题难度较大,在高考中较少出现,近年来主要出现在江苏高考题中。
解题方法与技巧是:明确等效平
本题难度:一般
3、选择题 仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是?????(????? )
A.加热
B.加压
C.减少生成物浓度
D.加大反应物浓度
参考答案:A
本题解析:略
本题难度:简单
4、选择题 对可逆反应4NH3(g)+5O2(g)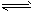 4NO(g)+6H2O(g),下列叙述正确的是[???? ] 4NO(g)+6H2O(g),下列叙述正确的是[???? ]
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若减小压强,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是
A.对于平衡体系:H2(g)+I2(g)==2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深
B.—定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小顺序是④>③>①>②
C.0.1mol?L-1的氨水加水稀释后,NH3?H2O的电离程度增大,c(OH-)增大,c(H+)减小
D.常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存
参考答案:A
本题解析:
试题分析:A、增大体系压强,I2的浓度增大,体系颜色加深但方程式两边气体分子数相同,平衡不移动,错误;B、NaOH是强碱,而CH3COONa、Na2CO3水解使溶液呈碱性,且越弱越水解,NaNO3是强酸强碱盐溶液定为中性,pH的大小顺序是④>③>①>②,正确;C、氨水加水稀释后,NH3?H20的电离程度增大,c(OH-)减小,c(H+)增大,错误;D、c(H+)/(OH-)=10-10,溶液呈碱性,Al3+不能存在,故错误。
本题难度:一般
|