微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( )
A.直线形
B.平面正方形
C.正四面体形
D.正八面体型
参考答案:C
本题解析:
本题难度:一般
2、选择题 有关乙炔分子中的化学键描述不正确的是 [???? ]
A.两个碳原子采用sp杂化方式
B.两个碳原子采用sp2杂化方式
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.一个分子中共有4个σ键
参考答案:BD
本题解析:
本题难度:一般
3、选择题 当硅原子由1s22s22p63s23p2→1s22s22p63s13p3时,以下认识正确的是( )
A.硅原子由基态转化成激发态,这一过程中吸收能量
B.硅原子由激发态转化成基态,这一过程中吸收能量
C.转化前位于3p能级上的两个电子处于同一轨道,且自旋方向相反
D.转化后硅原子与磷原子电子层结构相同,化学性质相似
参考答案:A
本题解析:
本题难度:一般
4、填空题 (三选一)【化学--选修?物质结构与性质】
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是_____________、_______________。
(2)基态铜原子的核外电子排布式为_______________,硫、氧元素相比,第一电离能较大的是_______?。
(3)反应①和②生成的气体分子的中心原子的杂化类型是____________,分子的空间构型是__________________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_________________;在该晶体中存在化学键的种类有_________?。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a?cm,则Cu2O的密度为_________?g/cm3(用NA表示阿伏加德罗常数的数值)。

参考答案:(1)2Cu2S+3O2![]() 本题解析:
本题解析:
本题难度:一般
5、填空题 下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素。
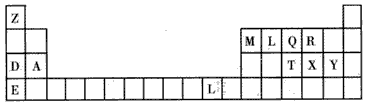
(1)由Z、R两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:___ ;这两种化合物中所含的化学键有____(填序号)。
a.离子键
b.极性共价键
c.非极性共价键
(2)T、X、Y原子的第一电离能的大小顺序是____(用元素符号表示,下同),其中电负性最小的是 ____;Y分别与D、E形成的化合物中,熔点较低的是__(用化学式表示)。
(3)QY3分子是___(填“极性分子”或“非极性分子”);MY3分子中,M原子采用___杂化方式。
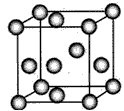
(4)基态Y原子的价电子排布式是____;L晶体的晶胞如下图所示,该晶胞中实际拥有___个L原子。
(5)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多种同分异构体(其中Q以三个单键与其他原子相连), 其沸点高低不同,其中一种物质沸点最高,主要原因是___。
参考答案:(1)2H2O2![]() 本题解析:
本题解析:
本题难度:困难