微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH溶液、MnO2、KMnO4、吸收少量SO2的NaOH溶液、浓盐酸、紫色石蕊试液、饱和NaCl溶液、BaCl2溶液、品红溶液。甲小组设计的实验装置图如下,在B中加入吸收少量SO2的NaOH溶液,D中加入1 mol·L-1 NaOH溶液。请回答下列问题:
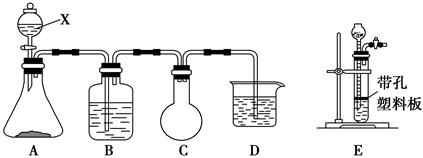
Ⅰ.(1)写出仪器X的名称:________。
(2)写出A中发生反应的化学方程式:__________________________________,
不能用E装置代替A装置的原因是___________________________________。
(3)C装置的作用是_________________________________________________。
(4)甲小组通过该实验要验证Cl2的________(填“漂白性”、“还原性”或“氧化性”)。
(5)乙小组认为甲小组设计的实验装置有缺陷,请你帮助甲小组完善该装置。即还要在________和________(填“A”、“B”、“C”或“D”)装置间连接一个装有________的洗气装置。
Ⅱ.丙小组认为反应一段时间后,B装置溶液(强碱性)中肯定存在Cl-、OH-和SO,可能还含有其他的阴离子。
请你设计实验帮助丙小组探究该吸收液中可能存在的其他阴离子。
(1)提出合理假设
假设1:只存在________,或只存在________。
假设2:可能两者都________(填“存在”或“不存在”)。
(2)请设计实验验证假设的正确性:___________________________________。
参考答案:Ⅰ.(1)分液漏斗
(2)2KMnO4+16HCl(浓
本题解析:本题考查物质的制备及性质探究
Ⅰ.(1)仪器X是分液漏斗。(2)A是制备氯气的装置,用高锰酸钾与浓盐酸制备氯气不必加热,而用二氧化锰与浓盐酸制备氯气需要加热,所以A中发生的是高锰酸钾与浓盐酸的反应。高锰酸钾是粉末状固体,所以不能用E代替A。(3)C是缓冲瓶,起防倒吸的作用。(4)由于B中是吸收了少量SO2的NaOH溶液,即含有两种溶质:NaOH和Na2SO3。当氯气通入B溶液中时,氯气将其中的Na2SO3氧化,表现出氧化性。(5)浓盐酸有挥发性,挥发出的HCl气体会与B中溶质发生反应,对氯气与Na2SO3的反应产生干扰。
Ⅱ.(1)氯气与NaOH反应生成NaCl、NaClO,所以吸收液中可能含有ClO-。由于吸收液呈强碱性,所以氯气不足,SO32-可能有剩余。又由于ClO-与SO32-可发生氧化还原反应生成Cl-与SO42-,所以二者可能都没有剩余。(2)如果存在SO32-,加入足量稀盐酸会生成二氧化硫,二氧化硫能使品红溶液褪色;如果存在ClO-,加入足量稀盐酸会生成氯气,紫色石蕊试液遇氯气先变红后褪色。
本题难度:一般
2、选择题 下列气体组(括号内为杂质)可用如图装置提纯的是(? )
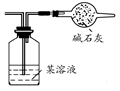
A.H2S(HCl)
B.NO2(CO2)
C.C2H6(C2H4)
D.CO2(H2S)
参考答案:C
本题解析:认真分析该装置的特点,由一个洗气瓶和一个干燥管组成。洗气瓶中溶液用来除去杂质气体,干燥管用来除去由洗气瓶中引入的水蒸气,但要注意碱石灰不能干燥酸性气体。碱石灰在吸收水蒸气的同时,H2S、NO2、CO2等酸性气体也可被吸收,故A、B、D选项不正确。
本题难度:简单
3、选择题 下列气体中,既可用浓硫酸干燥,又可用碱石灰干燥的是( )
A.O2
B.Cl2
C.SO2
D.NH3
参考答案:A、O2是中性气体,所以既能用浓硫酸又能用碱石灰干燥,故A正
本题解析:
本题难度:一般
4、填空题 化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知:
?
| 密度(g/cm3)
| 熔点(℃)
| 沸点(℃)
| 溶解性
|
环己醇
| 0.96
| 25
| 161
| 能溶于水
|
环己烯
| 0.81
| -103
| 83
| 难溶于水
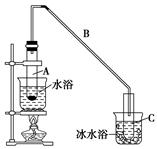
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A.KMnO4溶液???????? B.稀H2SO4????????????C.Na2CO3溶液

②再将环己烯按上图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,其目的是_____________________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
参考答案:(9分)(1)①冷凝 ②防止环己烯的挥发
(2)①上
本题解析:
试题分析:(1)由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;由于环己烯沸点低,易挥发,所以冰水浴的目的降低温度,防止环己烯的挥发。
(2)①环己烯的密度小于水的,不溶于水,所以在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,联想制备乙酸乙酯提纯产物时用饱和Na2CO3溶液洗涤可除去酸和醇,所以选择的水碳酸钠溶液。不能用酸性高锰酸钾,否则会氧化环己烯,答案选C。生石灰具有吸水性,所以蒸馏时要加入生石灰的目的是除去水分。
②冷却水的流向和气体的流向是相反的,因此冷却水从g口进入,f口出来。
③收集时,只要液体温度达到环己烯的沸点,能把其蒸馏出来就可以了,温度太低蒸馏不出。温度太高,易导致反应温度过高而碳化。因此根据环己烯的沸点可知,一般控制在83℃左右;,实验制得的环己烯精品质量低于理论产量,这说明反应物的转化率低,因此可能的原因是制备粗品时环己醇随产品一起蒸出,答案选C。
(3)区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品,混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,可判断产品的纯度,因此答案选BC。
点评:本题以有机合成为载体综合考查了实验室制环己烯的知识和醇、烃的性质,考查了学生综合运用实验的能力,属于中等难度的试题。答题时注意把握实验原理和方法,特别是实验的基本操作,学习中注意积累。
本题难度:一般
5、选择题 使用Na2CO3·10H2O晶体配制0.1 mol·L-1的Na2CO3溶液,其正确的方法是( )
A.称取该晶体28.6 g溶于1 L水中
B.称取10.6 g该晶体,溶于水制成1 L溶液
C.将该晶体加热除去结晶水,称取10.6 g溶于水中制成1 L溶液
D.称取该晶体28.6 g溶于水中制成1 L溶液
参考答案:D
本题解析:
试题分析:A、28.6g该晶体溶液1L水中后,溶液的体积不等于1L,故此方法错误。
B、10.6g该晶体中碳酸钠的物质的量小于0.1mol,配得的溶液的浓度小于0.1 mol·L-1,故此方法错误。
C、用此方法虽可配得正确浓度的溶液,但与题干的要求不相符合,故此方法错误。综上,答案选D。
点评:本题考查考查基本溶液的配制,属于基础题。解题时,应注意分子间存在间隙,因此1L水溶解溶质后,所得的溶液不等于1L。
本题难度:简单
|