微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10mol2?L-2、5.0×10-13mol2?L-2、8.3×10-17mol2?L-2.下列有关说法错误的是( )
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和溶液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和溶液中加入NaI固体有AgI沉淀析出
参考答案:A、根据化学式相似的物质的溶度积常数越小,物质越难溶可知常温
本题解析:
本题难度:简单
2、选择题 某温度下,Fe(OH)3(s)、Cu(OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
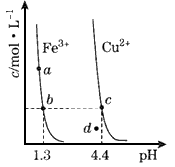
[???? ]
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4 Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
参考答案:B
本题解析:
本题难度:一般
3、选择题 工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3,下列有关CaSO4和CaCO3性质有 关推测正确的是
A.CaSO4是一种强酸弱碱盐
B.CaSO4溶解度小于CaCO3
C.CaSO4溶解度大于CaCO3
D.CaSO4溶解度等于CaCO3
参考答案:C
本题解析:
试题分析:CaSO4和CaCO3在一定条件下可以相互转化,CO32―+CaSO4 CaCO3+SO42―,A、不正确,CaSO4是一种强酸强碱盐;B、不正确,CaSO4是微溶物质,CaCO3是难溶物质,所以C正确;D不正确。选C.
CaCO3+SO42―,A、不正确,CaSO4是一种强酸强碱盐;B、不正确,CaSO4是微溶物质,CaCO3是难溶物质,所以C正确;D不正确。选C.
考点?:沉淀的转化
本题难度:简单
4、填空题 (5分)已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃)
|
沉淀溶解平衡
| Ksp
|
 AgBr(s) Ag+(aq)+Br-(aq) AgBr(s) Ag+(aq)+Br-(aq)
| 5,0×10-13mol2·L-2
|
 AgI(s) Ag+(aq)+I-(aq) AgI(s) Ag+(aq)+I-(aq)
| 8.3×10-17mol2·L-2
|
 FeS(s) Fe2+(aq)+S2-(aq) FeS(s) Fe2+(aq)+S2-(aq)
| 6.3×10-18mol2·L-2
|
 ZnS(s) Zn2+(aq)+S2-(aq) ZnS(s) Zn2+(aq)+S2-(aq)
| 1.6×10-24mol2·L-2
|
 CuS(s) CuS(s) Cu2+(aq)+S2-(aq) Cu2+(aq)+S2-(aq)
| 1.3×10-36mol2·L-2
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-] (填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+] (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:ZnS(s)  Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
参考答案:(1)AgBr>AgI>FeS>ZnS&g
本题解析:
试题分析:(1)AgBr、AgI、FeS、ZnS、CuS结构相似,溶度积越大,溶解能力越强,AgBr>AgI>FeS>ZnS>CuS;(2)碘化银的溶度积不变,加入硝酸银,银离子浓度增大,所以[I-]减小;AgBr的溶度积大于碘化银的溶度积,所以加入AgBr,[Ag+]增大;(3)最先生成溶度积小的物质,生成的沉淀的先后顺序是CuS、ZnS、FeS;(4)ZnS 的溶度积大于CuS,故A错误;ZnS 的溶度积小于FeS,FeS 能转化为ZuS,故B错误;加入少量FeCl2固体,生成FeS,ZnS减少,故C正确;加入少量CuCl2固体,生成CuS,ZnS减少,故D正确;
考点:本题考查溶解沉淀平衡。
本题难度:困难
5、填空题 (14分)工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
①N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol ②2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
③C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO的原理如图1,A为电源的 极,阴极反应式为 。
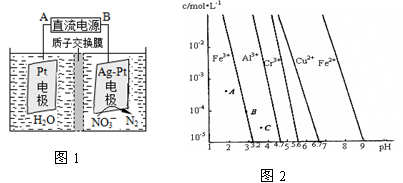
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
参考答案:(1)2NO(g)+2CO(g)=N2(g)+2CO2(g)
本题解析:
试题分析:③×2-②-①,整理可得:2NO(g)+2CO(g)=N2(g)+2CO2(g);ΔH=-746.5KJ/mol;(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,在反应中化合价升降总数相等,3×2x=3.5×3,解得x=1.75.设原混合气体中NO和NO2的物质的量之比为m:n,则(m+2n)÷(m+n)= 1.75,m:n="1:3" ;(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 在Ag—Pt电极上得到电子被还原变为N2,所以该电极是阴极,B是电源的负极,则A为电源的正极,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O;(4)①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的组成结构相同,当溶液中金属离子浓度相同时,哪种微粒的溶液中c(OH-)越大,则根据沉淀溶度积常数Ksp=c(M3+)·c3(OH-)的定义可知哪种金属沉淀物的溶度积常数就越大,画一条离子浓度小于1×10-5 mol/L的水平线,会发现:Cr(OH)3的c(OH-)最大,因此Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;图中A在沉淀溶解平衡先下侧,还没有达到沉淀溶解平衡,溶解速率大于沉淀速率,物质在不断的溶解;B点处于沉淀溶解平衡中,沉淀速率等于溶解速率,C点处于过饱和状态,沉淀速率大于溶解速率。因此A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是C点;②由图可得Fe(OH)2的溶度积的值为Ksp(Fe(OH)2)= c(Fe2+)·c2(OH-) =1×10-5× (1×10-5)2 = 1×10-15。 在Ag—Pt电极上得到电子被还原变为N2,所以该电极是阴极,B是电源的负极,则A为电源的正极,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O;(4)①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的组成结构相同,当溶液中金属离子浓度相同时,哪种微粒的溶液中c(OH-)越大,则根据沉淀溶度积常数Ksp=c(M3+)·c3(OH-)的定义可知哪种金属沉淀物的溶度积常数就越大,画一条离子浓度小于1×10-5 mol/L的水平线,会发现:Cr(OH)3的c(OH-)最大,因此Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;图中A在沉淀溶解平衡先下侧,还没有达到沉淀溶解平衡,溶解速率大于沉淀速率,物质在不断的溶解;B点处于沉淀溶解平衡中,沉淀速率等于溶解速率,C点处于过饱和状态,沉淀速率大于溶解速率。因此A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是C点;②由图可得Fe(OH)2的溶度积的值为Ksp(Fe(OH)2)= c(Fe2+)·c2(OH-) =1×10-5× (1×10-5)2 = 1×10-15。
考点:考查盖斯定律的应用、氧化还原反应中的计算、电化学的应用、沉淀溶解平衡的影响因素的知识。
本题难度:困难
|