微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语表示正确的是
A.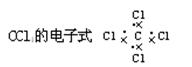
B.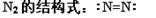
C.镁离子的结构示意图: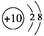
D.甲烷分子的比例模型:
参考答案:D
本题解析:A不正确,因为氯原子还有不参与成键的电子,应该是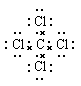 。结构式是用1根短线代替1对电子对,所以氮气的结构式为
。结构式是用1根短线代替1对电子对,所以氮气的结构式为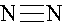 。镁离子的质
。镁离子的质
本题难度:一般
2、选择题 “灰霾加重光化学烟雾污染珠三角臭 氧浓度严重超标” 光化学烟雾主要有害物质是O3。它是由排放到大气中的氮的氧化物和碳氢化合物等在阳光照射下,发生光化学反应而形成的污染物。O3有较强的氧化性,有关反应的化学方程式为:O3+2KI+H2O = 2KOH+I2+O2,下列说法不正确的是(???)
氧浓度严重超标” 光化学烟雾主要有害物质是O3。它是由排放到大气中的氮的氧化物和碳氢化合物等在阳光照射下,发生光化学反应而形成的污染物。O3有较强的氧化性,有关反应的化学方程式为:O3+2KI+H2O = 2KOH+I2+O2,下列说法不正确的是(???)
A.城市中的氮的氧化物和碳氢化合物主要是汽车排出的废气造成
B.根据O3和KI溶液反应反可知,有1molO3参加反应,转移电子为6mol
C.光化学污染属二次污染。
D.O3和KI溶液反应中O2既不是氧化产物又不是还原产物
参考答案:B
本题解析:略
本题难度:一般
3、填空题 向FeI2溶液中不断通入Cl2,溶液中I-、I2、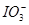 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。
、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。

已知:2Fe3++2I-=I2+2Fe2+。
请回答下列问题:
(1)指出图中折线E和线段C所表示的意义:折线E表示 ;线段C表示 。
(2)写出线段D所表示的反应的离子方程式: 。
(3)当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(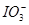 )= 。
)= 。
参考答案:(1)n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况
本题解析:(1)有关物质的还原性顺序为I->Fe2+>I2,则向FeI2溶液中不断通入Cl2的过程中,依次发生的氧化还原反应为Cl2+2I-=2Cl-+I2,Cl2+2Fe2+=2Fe3++2Cl-,5Cl2+I2+6H2O=2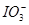 +12H++10Cl-。可见,当n(Cl2)∶n(FeI2)=1时,I-恰好全部被氧化;当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化;当n(Cl2)∶n(FeI2)=6.5时,氧化还原反应发生完毕。因此,当n(Cl2)∶n(FeI2)>1时,开始生成Fe3+,至n(Cl2)∶n(FeI2)=1.5时,n(Fe3+)达到最大值,故折线E代表了n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况;当n(Cl2)∶n(FeI2)>1.5时,开始生成
+12H++10Cl-。可见,当n(Cl2)∶n(FeI2)=1时,I-恰好全部被氧化;当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化;当n(Cl2)∶n(FeI2)=6.5时,氧化还原反应发生完毕。因此,当n(Cl2)∶n(FeI2)>1时,开始生成Fe3+,至n(Cl2)∶n(FeI2)=1.5时,n(Fe3+)达到最大值,故折线E代表了n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况;当n(Cl2)∶n(FeI2)>1.5时,开始生成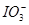 ,至n(Cl2)∶n(FeI2)=6.5时,n(
,至n(Cl2)∶n(FeI2)=6.5时,n(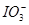 )达到最大值,故线段C代表了n(
)达到最大值,故线段C代表了n(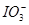 )随n(Cl2)∶n(FeI2)变化的情况。
)随n(Cl2)∶n(FeI2)变化的情况。
(2)当n(Cl2)∶n(FeI2)>1∶1时,Fe2+开始被氧化,当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化,故线段D代表了n(Fe2+)随n(Cl2)∶n(FeI2)变化的情况。线段D所发生反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-。
(3)当n(Cl2)∶n(FeI2)=6.5时,根据元素守恒,可知溶液中n(Cl-)∶n(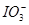 )=6.5。
)=6.5。
本题难度:一般
4、选择题 在反应5 NH4NO3 2 HNO3 +4 N2↑+9 H2O 中,氧化产物与还原产物的物质的量之比为
2 HNO3 +4 N2↑+9 H2O 中,氧化产物与还原产物的物质的量之比为
A.5∶3
B.3∶5
C.1∶1
D.2∶1
参考答案:A
本题解析:-3价的氮原子变到0价,所以,氨根离子是还原剂,5mol氨根离子,氧化产物是5mol,部分硝酸根离子得电子是氧化剂,得到的产物是还原产物4mol氮气中有5mol氮原子是氧化产物,其余3mol为还原产物,故氧化产物与还原产物的物质的量之比为5∶3,选A。
本题难度:一般
5、选择题 下列各反应中,水作为还原剂的是? (??? )
A.2H2+O2 2H2O
2H2O
B.SO3+H2O===H2SO4
C.2F2+2H2O===4HF+O2
D.2Na+2H2O===2NaOH+H2
参考答案:C
本题解析:
试题分析:失去电子,所含元素化合价升高的物质是还原剂,反之得当,所含元素化合价降低的物质是氧化剂。A中水是生成物,B中反应不是氧化还原反应,C中水是还原剂,单质氟是氧化剂,D中水是氧化剂,钠是还原剂,答案选C。
点评:该题是基础性试题的考查,试题注重基础知识的考查,难度不大。该题的关键是明确还原剂的概念和含义以及判断标准,有利于培养学生的逻辑思维能力。
本题难度:简单