微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温下,在pH=12的强碱溶液中,由水电离出的c(OH-)为(?????)
A.1.0×10-7 mol?L-1
B.1.0×10-6 mol?L-1
C.1.0×10-2 mol?L-1
D.1.0×10-12 mol?L-1
参考答案:D
本题解析:酸或碱就是抑制水的电离。pH=12的强碱溶液中,氢离子是水电离出的,其浓度是1.0×10-12 mol?L-1。根据水的电离方程式H2O H++OH-可知,水电离出的氢离子和OH-一定是相等的,所以由水电离出的c(OH-)也为1.0×10-12 mol?L-1。答案选D。
H++OH-可知,水电离出的氢离子和OH-一定是相等的,所以由水电离出的c(OH-)也为1.0×10-12 mol?L-1。答案选D。
本题难度:一般
2、填空题 液化气中的主要成分之一是丁烷。在25℃、101 kPa时,10 kg丁烷完全燃烧生成CO2和H2O(l)放出热量5×105kJ,丁烷燃烧的热化学方程式为_______________________________ 。丁烷的燃烧热为_________________。
参考答案:2C4H10(g)+13O2(g)==8CO2(g)+10H
本题解析:
本题难度:一般
3、选择题 将pH=3的盐酸a L 分别与下列三种溶液混合后,混合液均呈中性;
① 的氨水
的氨水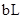 ?????? ②
?????? ②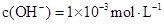 的氨水cL
的氨水cL
③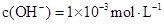 的
的 的溶液
的溶液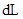
其中a、b、c、d的关系正确的是
A.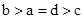
B.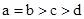
C.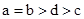
D.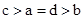
参考答案:A
本题解析:
试题分析:氨水是一元弱碱,氢氧化钡是强碱,如果盐酸和氨水恰好反应时,生成的氯化铵水解,溶液显酸性。如果溶液显碱性,则①中氨水的体积应该大于aL;②中氨水的浓度大于0.001mol/L,则反应中氨水的体积要小于aL;③中恰好反应时,溶液显中性,则a=d,所以正确的关系式是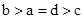 ,答案选A。
,答案选A。
点评:该题是高
本题难度:一般
4、选择题 下列溶液中各微粒的浓度关系正确的是
A.1.0mol/Lna2CO3溶液:c(OH一)=c(H+)+c(H2CO3)+c(HCO3-)
B.pH=6的纯水:c(H+)>c(OH一)
C. 物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c(NH4)2SO4>c(NH4HSO4)>c(NH4C1)
D.向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液: c(Na+)>c(CH3COO一)>c(H+)>c(OH一)
c(Na+)>c(CH3COO一)>c(H+)>c(OH一)
参考答案:C
本题解析:略
本题难度:简单
5、选择题 向20 mL氢氧化钠溶液中逐滴加入0. 2 mol/L醋酸溶液,滴定曲线如下图所示下列说法不正确的是?(??????)
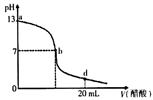
A.该氢氧化钠溶液的物质的量浓度为0.1 mol/L .
B.在b点,c (Na+)=c(CH3COO-)
C.在d点,溶液中所有离子浓度由大到小的顺序为
c (CH3COO-)>c (Na+)>c (H+)>c (OH-)
D.氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点
参考答案:D
本题解析:由图像得:V(醋酸)=0时,PH=13,即氢氧化钠溶液的PH=13,则C(OH-)="0.1" mol/L,故A正确;
在b点时,PH=7,则[H+]=[OH-],再利用电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-],故B正确;
在d点时,NaOH+CH3COOH=CH3COONa+H2O反应后,溶液变成为等浓度的CH3COOH、CH3COONa的混合物(前者考虑电离平衡,后者考虑水解平衡):PH<7,即:c (H+)>c (OH-),且同样存在电荷守恒:[Na+]+[H
本题难度:一般