微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
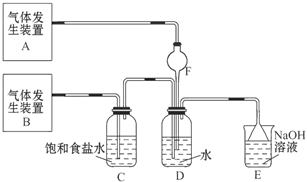
(1)气体发生装置A产生的气体是_____________。
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:①氯化铁溶液;②氯化亚铁溶液;③硫氰化钾溶液;④苯酚溶液;⑤品红溶液; ⑥酸性高锰酸钾溶液
Ⅰ.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入____________(选填一个序号)试剂,实验现象是:???????????????????????。
Ⅱ.若SO2过量:取适量D中溶液滴加至盛有____________(选填一个序号)的试管内,实验现象是:__________________________________。
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
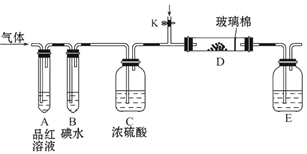
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?____________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为?????????????????????????。
参考答案:(1)SO2???????
(2)Ⅰ.②???③(或④
本题解析:
试题分析:(1)SO2易溶于水且与水能反应,所以通入水中溶液发生倒吸,F装置可以防倒吸,所以装置B为制取SO2的装置。
(2)Ⅰ.若Cl2过量,取适量D中溶液滴加至盛有氯化亚铁溶液试剂的试管内,Cl2可把Fe2+氧化为Fe3+,再加入硫氰化钾溶液会变血红色,或再加入苯酚溶液会变为紫色,根据溶液颜色的变化可证明氯气氧氧化亚铁离子过量。
Ⅱ.若SO2过量,取适量D中溶液滴加至盛有品红溶液的试管中,红色褪去,加热又恢复红色,证明含有二氧化硫。
(3)①二氧化硫能和有色物质反应生成无色物
本题难度:一般
2、选择题 将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
选项
| X
| Y
|
A
| SO2
| Cl2
|
B
| NO2
| SO2
|
C
| NH3
| CO2
|
D
| Cl2
| CO2
?
参考答案:D
本题解析:
试题分析:A. SO2+H2O =H2SO3.再通入Cl2发生反应:H2SO3+ Cl2+H2O =H2SO4+2HCl;H2SO4+ BaCl2= BaSO4↓+2HCl。正确。B. NO2+H2O =HNO3+NO;2HNO3+3SO2+2H2O =3H2SO4+2NO↑; H2SO4+ BaCl2= BaSO4↓+2HCl。正确。C. NH3+H2O = NH3?H2O; 2NH3?H2O+ CO2="(" NH4)2CO3+H2O; ( NH4)2CO3+ BaCl2= BaCO3↓+ 2
本题难度:一般
3、选择题 下列反应中氯气既作氧化剂又作还原剂的是(??? )
A.氯气和氢气
B.氯气和铜
C.用氯气制备漂白粉
D.氯气溶于亚硫酸溶液
参考答案:C
本题解析:氯有多种化合价态,在大多数反应中氯会得到电子成为-1价的氯的化合物,这时氯气为氧化剂。但在某些反应中(如C中)氯气也会失去电子,成为高价态的化合物。这时氯气作还原剂。
点评:Cl2因Cl原子核外只有3个电子层,最外层有7个电子,在化学反应中很容易得电子表现出强氧化性。其还原性一般只在歧化反应中体现出来。
本题难度:简单
4、简答题 图是实验室制取Cl2并以纯净、干燥的Cl2为原料进行特定反应的实验装置图:

(1)写出实验室制取氯气的离子反应方程式:______.
(2)C中盛装的液体是______,D中盛装的液体是______.
(3)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃E处的酒精灯.E装置内盛有铁粉,写出E装置中反应的化学方程式:______;
(4)E处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______,B的作用是______.
(5)该装置的设计是否合理______(填“是“或“否”),如果不合理,请加以改正______.
参考答案:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化
本题解析:
本题难度:一般
5、填空题 向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察下图所记录的现象,判断各瓶注入的液体是什么,将注入液体的编码填入图下方相应的括号中。
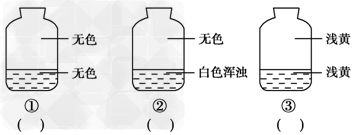
A.AgNO3溶液??B.NaOH溶液???C.水
参考答案:①B;②A;③C
本题解析:
本题难度:一般
|