微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某金属能与稀盐酸反应生成氢气,该金属与锌组成原电池时,锌做负极,此金属是[???? ]
A.Mg
B.Fe
C.Al
D.Cu
2、选择题 观察下列几个装置示意图,有关叙述错误的是(????)
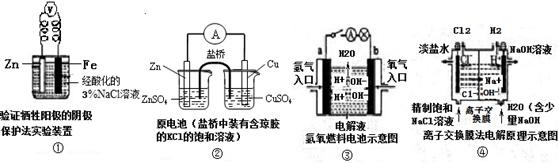
A.装置①中烧杯内中加入黄色的K3[Fe(CN)6]溶液,一段时间后看不到Fe电极附近有蓝色沉淀生成,该装置可看作金属的析氢腐蚀
B.装置②盐桥中的Cl—向硫酸铜溶液移动
C.装置③中外电路电流方向:b极 →a极
D.装置④中阳极反应:2 Cl——2e- = Cl2 ↑
3、选择题 在如图所示的原电池中,下列说法正确的是( )
A.Cu为负极,Zn为正极
B.负极反应为:Zn-2e-=Zn2+
C.正极反应为:Cu2++2e-=Cu
D.正极发生氧化反应,负极发生还原反应

4、选择题 结合下图判断,下列叙述正确的是
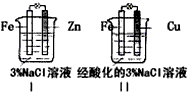 [???? ]
[???? ]
A. I和II中正极均被保护
B. I和II中负极反应均是Fe-2e-=Fe2+
C. I和II中正极反应均是O2+2H2O+4e-=4OH-
D. I和II中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
5、填空题 铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物
(1)要确定铁的某氯化物FeClx的化学式。可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预防处理,再通过含有饱和OH-的阴离子交换柱,使
Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol/L的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中X值
(2)现有一含有FeCl2和FeCl3的混合样品,采用上述方法测得n(Fe):?n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为_______________。在实验室中,FeCl2可用铁粉和____反应制备,
FeCl3可用铁粉和_______反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与
KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为______与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________,该电池总反应的离子方程式为________________。