微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 (8分)B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体。
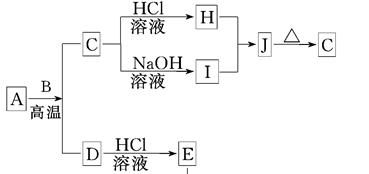
(1)在E的溶液中加入氢氧化钠溶液,可以观察到的现象是________________________.
(2)按要求写化学方程式或离子方程式:
①A与B在高温条件下生成C和D的化学方程式:____________________________;
②在E的水溶液中通入氯气后的生成物和I溶液反应的离子方程式:???????????????。
(3)由D和A组成的混合物与稀HCl作用,固体恰好溶解,所得溶液中滴加KSCN溶液不显红色,且生成的E与H2的物质的量之比为4:1。则反应物中A、D、HCl的物质的量之比为____。
参考答案:(8分)(1)先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
本题解析:
试题分析:A是一种红棕色金属氧化物,则A是氧化铁。电解熔融态的C得到B单质,而J是一种难溶于水的白色固体,这说明C是氧化铝,B是金属铝,H是氯化铝,I是偏铝酸钠,二者反应生成氢氧化铝,即J是氢氧化铝。A和B的反应是铝热反应,则D是铁,E是氯化亚铁。
点评:该题是高考中的常见题型,试题综合性强,难度较大,对学生的综合素质提出了更高的要求。该题学生需要明确化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解
本题难度:困难
2、简答题 ( I)某无色稀溶液X中,可能含有下表所列离子中的某几种.
| 阴离子 | CO32-、SiO32-、AlO2-、Cl-
阳离子
Al3+、Cu2+、Mg2+、NH4+、Na+
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示.
(1)若Y是盐酸,则溶液中含有的金属阳离子是______,ab段发生反应的总离子方程式为______,Oa段上表中参加反应的离子的物质的量之比为:______[要标明离子符号,如n(Na+)].
(2)若Y是NaOH溶液,则bc段反应的离子方程式为______.若不考虑离子的水解因素,忽略H+和OH-影响,且溶液中只存在四种离子,则它们的离子个数比为______[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].
( II)锡为第IVA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处.已知锡元素具有如下性质:①Sn4++Sn═2Sn2+;②2Sn2++O2+4H+═2Sn4++2H2O;③2H++SnO22-?Sn(OH)2?Sn2++2OH-,试回答:
(1)锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:__ ____,______.
(2)将(1)中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)______.
(3)若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱是______.

参考答案:溶液无色说明溶液中不含铜离子;
(1)如果Y是盐酸,向
本题解析:
本题难度:简单
3、推断题 已知A、B、E是常见的非金属单质,C是导致酸雨的主要成分之一,Y是生活中常见的金属单质。D、K是重要的无机化工产品。X含有两种元素,具有摇篮式的分子结构,其球棍模型如图所示。H为白色沉淀。下列转化关系中部分反应条件和产物略去。

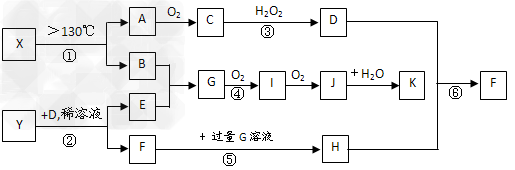
试回答下列问题
(1)X的化学式为______________;G的电子式______________;
(2)反应④的化学方程式_______________________;反应③的离子方程式____________________________;??
(3)用水稀释0.1?mol/LG溶液时,溶液中随着水量的增加而减小的是_______(填写序号)? ①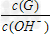 ?????② ?????②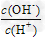 ??????③?c(H+)和c(OH-)的乘积?????④?OH-的物质的量 ??????③?c(H+)和c(OH-)的乘积?????④?OH-的物质的量
(4)室温下,向0.01mol/L?G溶液中滴加0.01mol/L?D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
(5)①~⑥反应中属于氧化还原反应的是(填编号)___________;
(6)依据实验中的特征实验现象,可确定Y是何种金属,该实验现象为____________。
参考答案:(1)S4N4?;![]() 本题解析: 本题解析:
本题难度:一般
4、推断题 物质A有如图所示转化关系,其中乙为金属单质,常温下,它在G的浓溶液中发生钝化,F的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。

请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同):
(1)第一种情况:A为气体;用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质;D和F的溶液均呈碱性。则:
①D与乙反应的离子方程式为___________________;
②用离子方程式表示F溶液显碱性的原因:_______________________。
(2)第二种情况:A是工业上常见的矿石,甲可由两种单质直接化合得到,D的水溶液加入HNO3酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应I在__________(填设备名称)中进行;
②用电子式表示化合物甲的形成过程:_____________________;
③D和乙反应的离子方程式为__________________;
④反应Ⅱ的化学方程式为__________________。
参考答案:(1)①2Al+2OH-+2H2O=2AlO2-+3H2↑;
本题解析:
本题难度:一般
5、填空题 (8分)单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多1,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀,各物质间的转化关系如图所示(反应条件多数已略去):

请回答:
(1)反应⑥的离子方程式是_______________________________________________。
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________。
(3)在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是_______________________________________________
________________________________________________________________________。
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是________________________________________________________
________________________________________________________________________。
(5)反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式________________________________________________________________________。
参考答案:(1)Cu(OH)2+2H+===Cu2++2H2O
本题解析:由题给信息知丙元素为Cl,H为Cu(OH)2,化合物D为H2O,则A为O2,B为H2,C为Cl2,G为Cu。
本题难度:一般
|