微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 电解质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,此时溶液中符合下表关系的是 [???? ]
NaOH的质量分数?
阳极析出物质的质量/g
?阴极析出物质的质量/g
A.
0.062(6.2%)
19
?152
B.
0.062(6.2%)
?152
19
C.
0.042(4.2%)?
1.2
9.4
D.
0.042(4.2%)?
9.4
?1.2
参考答案:B
本题解析:
本题难度:一般
2、选择题 工业上电解饱和食盐能制取多种化工原料,如图是离子交换膜法电解饱和食盐水示意图,下列说法中不正确的是( )
A.电解槽阳极的反应方程式为:2Cl--2e-═Cl2↑
B.产品?NaOH的出口是b
C.精制饱和食盐水的进口为d
D.干燥塔中应使用的液体是浓硫酸
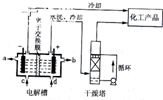
参考答案:A、依据图装置可知电解槽中阳极是氯离子放电生成氯气,电极反应
本题解析:
本题难度:简单
3、填空题 (12分)某校课外兴趣小组用如图装置进行电解CuC12溶液的实验。实验时 ,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究:
,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究:
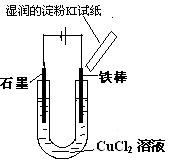
(1)阳极产物探究。
根据实验现象,同学们对阳极发生的电极反应提出了如下假设:
假设1?????????????????????????????????????????;
假设2?????????????????????????????????????????。
请你设计实验方案证明你的假设(包括:操作→现象→结论):?????????????????????????????????????????????。
(2)阴极产物探究:
查阅资料
| 铜和铜的化合物中Cu、Cu2O为红色,CuCl、CuBr、CuI为白色,它们在水中均不溶,且稳定存在。
|
探究实验
| 取出阴极碳棒,并将其干燥,然后用如图所示装置(气密性良好,药品性能良好)进行实验并记录现象:
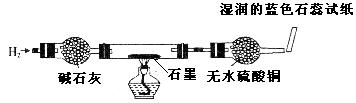
现象:碳棒上红色物质依然存在;白色物质变为红色;无水硫酸铜仍为白色;蓝色 石蕊试纸变为红色 石蕊试纸变为红色
结论与解释:
①白色物质为????????????。
②某学生收集碳棒上的白色物质并装入试管中,滴人稀HNO3,写出白色物质与稀HNO3反应的离子方程式:?????????????????????????????????????????????????。
参考答案:(1) 本题解析:略 本题解析:略
本题难度:简单
4、实验题 (11分)下图表示两种溶液进行电解的装置:
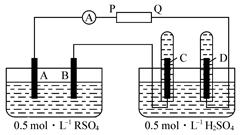
电极A由金属R制成,R的硫酸盐的化学式为RSO4,B、C、D都是Pt。P和Q是电池的两极,电路接通后,金属离子R2+离子沉积于电极B上,同时电极C、D上产生气泡。
(1)P和Q中正极是__________。
(2)A极上的电极反应式为_______________________。
(3)罩在电极C、D上的两集气瓶中收集到气体的体积比是__________。
(4)当电流强度为2 A,通电3 min 13 s后,电极B上生成金属R 0.127 g。已知1 mol电子的电量为96 500 C,则R的相对原子质量为__________,它是__________(填元素符号)。
(5)将P和Q变换位置接线,使电流方向反过来,电流强度为2 A,5 min后在B极上看到了_____________、_______________________两种现象。
参考答案:(1)P? (2)R-2e-====R2+? (3)1∶2?
本题解析:提示:R2+离子沉积于电极B,则电极B必定是阴极,与阴极相连的Q是电源的负极,P是电源的正极,A、C、D分别为阳极、阳极、阴极。(4)根据电量=It= ×2×96 500 C·mol-1得:M= ×2×96 500 C·mol-1得:M= 本题难度:简单 本题难度:简单
5、填空题 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
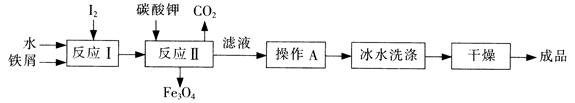
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
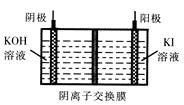
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
参考答案:(1)① Fe3I8 + 4K2CO3 = Fe3O4 +
本题解析:
试题分析:(1)①反应I生成铁与碘的化合物,铁元素与碘元素的质量比为21:127,即物质的量比是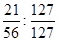 =3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。 =3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
②用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)①烹饪时,含KIO3的食盐常在出锅前加入,其原因是在较高温度下KIO3易分解;
②因为H2O2氧化I2先制得HIO3:5H2O2+I2==2HIO3+4H2O,即5H2O2~2IO3-,1284 kg KIO3固体为6k mol,故m(H2O2)= 5/2×6kmol×34g·mol-1/30%=1700kg。
③虽然阴极区有大量氢氧根离子生成,但阳极区反应消耗氢氧根离子,氢氧根离子通过阴离子交换膜到阳极区反应,总反应中没有酸或碱生成以及消耗。故而阴极区反应前后pH没有变化。当然,如果题目没有“忽略溶液体积变化“的说明,情况就不同了,随着电解的进行,总反应耗水,阴极区pH会增大。
考点:官能团为酯键的芳香化合物的性质。
本题难度:一般
|