微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各种说法中,都包含有前后两个数值,其中前者大于后者的是
A.在25℃和80℃时纯水中的c[H +] 浓度
B.室温时,浓度均为 0.1 mol·L-1 的 (NH4)2SO4(aq)、(NH4)2CO3 (aq)的 c (NH4+)
C.相同条件下,0.l mol·L-1 NaHCO3 和 0.1 mol·L-1 Na2CO3 溶液的 pH
D.1 L饱和CH3COONa溶液中CH3COO- 和Na+的个数
参考答案:B
本题解析:
正确答案:B
A.不正确,在25℃和80℃时纯水中的c[H +] 浓度,H2O电离吸热,升温更利于电离,80℃时c(H+)大
B.正确,室温时,浓度均为 0.1? mol·L-1 的 (NH4)2CO3 (aq)的 NH4+与CO32―的水解相互促进。
C.不正确,相同条件下,0.l mol·L-1 NaHCO3 和 0.1 mol·L-1 Na2CO3 溶液,Na2CO3 溶液更容易水解,Na2CO3 溶液的 pH更大
D.不正确,1 L饱和CH3COONa溶液中CH3C
本题难度:简单
2、选择题 属于电解质,且溶于水时会影响水的电离平衡的是
A.氯气
B.二氧化碳
C.碘化钾
D.醋酸钠
参考答案:D
本题解析:电解质首先必须为化合物,排除A;CO2本身不能电离出离子,为非电解质,排除;
而水的电离一般受浓度、温度、酸、碱、盐的影响,其中的碘化钾不不能影响水的电离平衡的移动,而醋酸钠可发生水解,促进水的电离。
本题难度:一般
3、选择题 已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是(?)
A.a=b
B.混合溶液的PH=7
C.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
D.混合溶液中,c(H+)=
参考答案:D
本题解析:
试题分析:若a=b且HA和BOH分别是强酸和强碱或分别是弱酸、弱碱且它们的电离常数相同,所得溶液呈中性,A错误;常温下,pH=7的溶液呈中性,B错误;无论溶液呈酸性、碱性或中性,都有电荷守恒c(H+)+ c(B+)= c(OH-)+ c(A-),C错误;c(H+)·c(OH-)=Kw,所以c(H+)= 本题难度:一般
本题难度:一般
4、选择题 常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①与②中c(H+)相同
B.①与④混合,所得混合液的PH等于7
C.②和③混合,所得混合溶液的pH大于7
D.③与④分别用等浓度的盐酸中和,消耗盐酸的体积相等
参考答案:AC
本题解析:略
本题难度:一般
5、选择题 pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。下列说法正确的是(???)
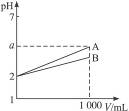
A.A、B两酸溶液的物质的量浓度一定相等??? B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸????????????? D.若A、B都是弱酸,则5>a>2
参考答案:CD
本题解析:pH相同的两酸稀释相同倍数,B的pH变化小,说明B是比A弱的酸,则pH相同的两酸的物质的量浓度是c(B)>c(A),稀释后A酸的pH大于B酸的pH,故A酸的c(H+)小于B酸的c(H+),A酸溶液酸性较弱。若是pH=2的强酸稀释到原来的1 000倍,稀释后的c(H+)=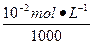 =10-5 mol·L-1,pH=5,弱酸
=10-5 mol·L-1,pH=5,弱酸
本题难度:简单