微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。
已知:
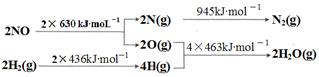
则H2还原NO生成氮气和水蒸气的热化学方程式是:
??????????????????????????????????????????????????。
(2)在一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g)  CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol·L一1,H2 0.8mol·L一1,CH40.8mol·L一1,H2O1.6mol·L一1。则CO2的平衡转化率为???。上述反应的平衡常数表达式K=?????。200℃时该反应的平衡常数K=64.8,则该反应的△H???0(填“>’’或“<”)。
(3)某研究小组以H2与CaCl2制备某种钙的化合物。已知反应只生成甲、乙两种化合物。对产物分析发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为????????????。
②甲与水反应可得H2,其化学方程式是:
????????????????????????????????。
(4)H2的获得途径很多,由哈工大研究小组设计的微生物电解有机废水法,既可以清除废水中的有机杂质,同时可以获得氢气。下图为一种处理含甲醇工业废水的微生物电解池,写出电解过程中,阳极发生的电极反应式:?????????????????。

参考答案:(1)2NO(g) +2H2(g)=N2(g) + 2H2O
本题解析:
试题分析:(1)首先写出H2还原NO生成氮气和水蒸气的化学方程式并注明状态:2NO(g) +2H2(g)=N2(g) + 2H2O(g),然后根据键能求出焓变,?H=2×630kJ?mol?1+2×436kJ?mol?1—945kJ?mol?1—4×463kJ?mol?1=-665kJ·moL-1,可得热化学方程式。
(2)设起始时CO2和H2的物质的量浓度分别为x、y;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始浓度(mol?L?1) x???? y??? 0???? 0
变化浓度(mol?L?1) 0.8????3.2??? 0.8???? 1.6??
平衡浓度(mol?L?1) 0.2???? 0.8??0.8????1.6
x=0.8mol?L?1 +0.2mol?L?1 =1mol?L?1,y=3.2mol?L?1 +0.8mol?L?1 =4mol/L;
CO2的平衡转化率=0.8mol?L?1÷1mol?L?1×100%=80%;根据平衡常数的含义可知平衡常数表达式K= c(CH4)·c2(H2O)/c(CO2)·c4(H2);300℃时平衡常数为:0.8×1.62????÷(0.2×0.84)=25,200℃时该反应的平衡常数K=64.8,说明温度升高,平衡常数减小,平衡向逆反应方向移动,则该反应为放热反应,?H<0。
(3)①化合物乙的水溶液显酸性,根据元素守恒知乙为氯化氢。
②化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=52.29%/40:46.41%/35.5:(1-52.29%-46.41%)/1=1:1:1,所以所以甲的化学式为CaHCl,甲和水反应生成氢气,同时生成氯化钙、氢氧化钙,反应方程式为:2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑
(4)阳极上发生CH3OH失电子反应,电极方程式为:CH3OH-6e—+H2O=CO2↑+6H+
本题难度:一般
2、选择题 若15 gA物质与10.5 gB物质恰好完全反应,生成9 gC物质量和0.3 molD物质,则D物质量的摩尔质量是
A.55 g
B.55 g/mol
C.111 g/mol
D.27.5 g/mol
参考答案:B
本题解析:
本题难度:简单
3、选择题 某温度下,在甲、乙、丙三个恒容密闭容器中投入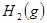 和
和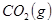 ,发生反应
,发生反应
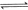
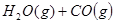 ,其起始浓度如下表所示。测得平衡时甲中
,其起始浓度如下表所示。测得平衡时甲中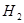 的转化率是60%。下列判断正确的是
的转化率是60%。下列判断正确的是
起始浓度
| 甲
| 乙
| 丙
|
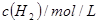
| 0.010
| 0.020
| 0.020
|

| 0.010
| 0.010
| 0.020
A. 甲中达到平衡所需时间最短
B. 平衡时,反应的平衡常数
C. 平衡时,丙中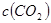 是甲中的2倍 是甲中的2倍
D. 平衡时,乙和丙中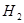 的转化率均是60% 的转化率均是60%
参考答案:C
本题解析:甲中反应物的浓度最小,反应速率最小,到达平衡的时间最长,A不正确。由于反应前后体积不变,所以丙中平衡和甲中是等效的,但物质但浓度是甲中的2倍,C正确。乙相当于再甲的基础上,再通入0.01mol氢气,所以能通过CO2的转化率,即乙中CO2的转化率大于60%,因此选项D不正确。根据甲中可知,平衡时氢气和CO2分别都是0.004mol,CO和H2O是0.06mol,所以平衡常数K=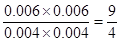 ,B不正确,答案选C。 ,B不正确,答案选C。
本题难度:一般
4、选择题 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是? 2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是?

A.点c处反应达到平衡
B.点d (t1时刻)和点e (t2时刻)处n(N2)不一样
C.其他条件不变,773K下反应至t1时刻,n(H2)比上图中的d点值要大
D.点a的正反应速率比点b的小
参考答案:C
本题解析:c点物质的浓度还是变化的,没有达到平衡状态,A不正确;点d (t1时刻)和点e (t2时刻)都处于同一个平衡状态,氮气的物质的量相同,B不正确;正反应是放热反应,升高温度,平衡向逆反应方向进行,因此氢气的含量增加,选项C正确;a点反应物的浓度大于b点,因此a点反应速率大,D不正确,答案选C。
本题难度:一般
5、填空题 (7分)在某温度下合成氨:N2+3H2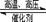 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答: 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
(1)写出该反应的平衡常数表达式:_____________,KA_____ _KB(填“>”、“<”或“=”)。 _KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低??????????????????????????????? B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措 施为__________。 施为__________。
A.升高温度????????????????????????????????? B.降低温度??????
C.增大N2、H2的浓度????????????? D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡 时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占 时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占 的比例较大。 的比例较大。
?
| 容器A
| 容器B
| M(平)
| 20
| ?
| 平衡时N2的转化率
| ?
| 10%
参考答案:(1)K=c2(NH3) /[c(N2) c3(H2)],K
本题解析:略
本题难度:简单
|
|