微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铂作电极电解下列溶液,当消耗相同电量时,在阴极上有金属析出且溶液的pH下降的是
A.KCl
B.CuCl2
C.CuSO4
D.HCl
参考答案:C
本题解析:在阴极上有金属析出,则溶液中须有不活泼金属阳离子,排除AD选项。电解CuCl2生成铜和氯气,放电完毕体系中只剩下水,显中性,故电解过程pH增大,B错。电解CuSO4会生成硫酸,溶液的pH下降,故选C
本题难度:一般
2、简答题 “化学与技术”模块
海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.
(1)常用的海水淡化方法有______法、______法(电渗析、反渗透)、冷冻法、离子交换法等.
(2)如图是电渗析法淡化海水的原理图.其中,电极A接直流电源的 正极,电极B接直流电源的负极.
①隔膜A是______(填:阴离子交换膜或阳离子交换膜)
②从宁波港采集的海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-.
若用上述装置对采自宁波港的海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、
pHc,则其大小顺序为______.
③请写出用电渗析法对采自宁波港的海水进行淡化处理时所发生的化学反应方程式______.
(3)具有暂时硬度的硬水在长时间加热煮沸后,生成沉淀的主要成分是______.
(4)为获得纯净水(去离子水),某同学在实验室将含Mg2+、Ca2+、Cl-的硬水先后通过阴离子交换树脂[如RN(CH3)3OH]和阳离子交换树脂[如RSO3H],写出Cl-与上述离子交换反应的方程式______;结果实验未获得成功,其可能原因是______.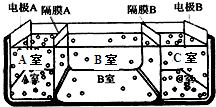
参考答案:(1)海水淡化常见的方法有:蒸馏法、膜法、冷冻法、离子交换法
本题解析:
本题难度:一般
3、选择题 β′Al2O3陶瓷作固体电解质,反应式如下:2Na+xS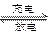 Na2Sx,以下说法正确的是
Na2Sx,以下说法正确的是
A.放电时,Na作正极,S极发生还原反应
B.若用此电池电解硝酸银溶液,当阴极上产生标准状况下气体1.12 L时,消耗金属钠2.3 g
C.充电时,钠极与外电源的正极相连
D.充电时,阳极发生的反应为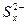
 xS+2e-
xS+2e-
参考答案:D
本题解析:作为充电电池,当其充电时,相当于电解池;放电时,为原电池。已知原电池负极发生的是氧化反应(即元素价态升高),正极发生的是还原反应(元素价态降低);电解池中,阴极发生还原反应(元素价态降低),阳极发生的是氧化反应(元素价态升高)。由此分析A项中,Na为负极,故错误。B项据电子守恒及离子放电顺序知,电解时阳极产生的气体为O2,转移电子的物质的量为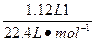 本题难度:简单
本题难度:简单
4、填空题 (12分)6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍。用化学用语回答下列问题:
| X
| Y
| Z
|
W
|
| M
| Q
(1)Y在周期表中的位置是________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序是________。
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是________。
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是________。
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料。甲的电子式是 ,实验室制备甲的化学方程式是________,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是 。X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是 。
(6)工业上用下图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂。该反应的离子方程式是 。
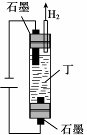
参考答案:(12分)
(1)二周期ⅥA族(1分)
(2)r
本题解析:
试题分析:X为氮,Y为氧,Z氟,W为硅,M为硫,Q为氯。(1)氧元素在第二周期ⅥA族。(2)同周期元素原子半径从左到右减小,所以半径顺序为:r(N)>r(O)>r(F)。(3)非金属性越强,其最高价氧化物对应的水化物酸性越强,同周期元素从左到右非金属性增强,所以酸性增强,顺序为:HClO4>H2SO4>H2SiO3。(4)二氧化硅和氢氟酸反应生成四氟化硅和水,方程式为:SiO2+4HF===SiF4+2H2O。(5)氮的氢化物为氨气,电子式为: ,实验室用氯化铵和氢氧化钙反应制取,方程式为:2NH4Cl+Ca(OH)2 ,实验室用氯化铵和氢氧化钙反应制取,方程式为:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。氨气和硝酸反应生成硝酸铵,由于铵根离子水解,溶液显碱性,所以离子顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-)。氮的18电子氢化物为N2H4,在原电池中失去电子生成无污染的氮气,电极反应为:N2H4-4e-+4OH-===N2+4H2O。(6)电解氯化钠溶液,由于生成的氯气和生成的氢氧化钠反应又生成了氯化钠和次氯酸钠,所以电解的结果为:Cl-+H2O CaCl2+2NH3↑+2H2O。氨气和硝酸反应生成硝酸铵,由于铵根离子水解,溶液显碱性,所以离子顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-)。氮的18电子氢化物为N2H4,在原电池中失去电子生成无污染的氮气,电极反应为:N2H4-4e-+4OH-===N2+4H2O。(6)电解氯化钠溶液,由于生成的氯气和生成的氢氧化钠反应又生成了氯化钠和次氯酸钠,所以电解的结果为:Cl-+H2O ClO-+H2↑。 ClO-+H2↑。
考点:元素周期表的推断,元素周期律,实验室制取氨气,电解原理的应用
本题难度:困难
5、选择题 在100mLH2SO4和CuSO4的混合液中,用石墨作电极电解一段时间,两极均收到2.24L气体(标准状况),则原混合液中,Cu2+的物质的量浓度为( )
A.1mol?L-1
B.2mol?L-1
C.3mol?L-1
D.4mol?L-1
参考答案:电解0.1LH2SO4和CuSO4的混合溶液,阳极发生的反应
本题解析:
本题难度:简单
|