微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3 mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( )
A.阳极上析出11.2 mL O2(标准状况)
B.阴极上析出32 mg Cu
C.阴极上析出11.2 mL H2(标准状况)
D.阳极和阴极质量都无变化
参考答案:B
本题解析:
试题分析:A.当有1×10-3 mol的OH-放电时,则n(e-)=1×10-3 mol.在阳极发生反应:4OH--4e-= O2↑+2H2O。n(O2)= 1×10-3 mol×1/4=2.5×10-4 mol.V(O2)= 2.5×10-4 mol×22.4L/mol=5.6×10-3L=5.6 ml.误。B.在阴极由于放电能力Cu2+>H+。所以电极反应为Cu2++2e-=Cu。在整个闭合回路中电子转移数目相等,所以n(Cu)= 1/2×10-3 mol=5×10-4 mol.m(Cu
本题难度:一般
2、填空题 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
参考答案:(1)正 C (2)阴离子 阳离子 (3)H2-2e-+2O
本题解析:题图中左边加入含硫酸的水,暗示左边制硫酸,即OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜。所以,C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-=4OH-,负极反应式为2H2-4e-+4OH-=4H2O。(4)n(H2)=0.5 mol,2H++2e-=H2↑,得电子为1 mol,X极的反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑,根据电子守恒知,生成H+的物质的量为1 mol,故生成0.5 mol H2SO4,m(H2SO4)=49 g。
本题难度:一般
3、填空题 现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl 2。请回答下列问题:
⑴在电解过程中,与电源正极相连的电极上所发生的电极反应式为?????????????????。
⑵电解之前,食盐水需要精制,目的是除去粗盐中的、Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为(填试剂序号)?????????????????????????????。
⑶如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)Cl2,这时溶液的pH值是??????(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)???????????????。
⑷若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是?????????????????
????????????????????????????????????????????????????????????。
参考答案:⑴2Cl-→ Cl2↑+2e-;⑵b、a、c;⑶升高,0.1
本题解析:此题是在考查电解食盐水的基础之上,同时考查粗盐的精制。解题时,要紧扣电解原理,电子守恒分析。⑴与电源正极相连的是阳极,阴离子Cl-放电,电极反应式为:2Cl-→ Cl2↑+2e-。⑵加入Ba(OH)2后过量的Ba2+应该用Na2CO3溶液除去,最后加入盐酸除去,并调节溶液的酸碱性(加盐酸之前,必须过滤,否则沉淀又溶解了)。⑶电解饱和食盐水过程中产生了NaOH,使溶液的碱性增强,pH值升高;依据总方程式:2NaCl+2H2O 本题难度:一般
本题难度:一般
4、填空题 甲、乙两个容器中,分别加入0.1mol/L NaCl溶液与0.1mol/L AgNO3溶液后,以Pt为电极进行电解时, (14分)
(14分)
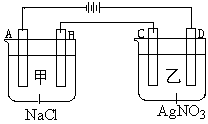
(1)写出电极名称和电极反应式:
A???????????????????????????????????????????
B???????????????????????????????????????????
C???????????????????????????????????????????
D??????? ????????????????????????????????????
????????????????????????????????????
(2)在A、D电极上生成的气体物质的量之比为:_____________
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
5、填空题 工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):已知:Cu2O+2H+===Cu2++Cu+H2O。
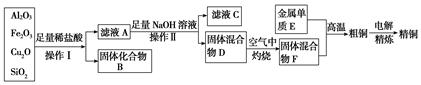
(1)滤液A中铁元素的可能存在形式为________(填离子符号),与之相关的离子方程式为 ; 。
若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为 。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是________(填序号)。
a.若用硫酸铜溶液作电解液, 向阴极移动
向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
参考答案:(1)Fe2+(或Fe2+和Fe3+) (1分)F
本题解析:
试题分析:SiO2与盐酸不反应,Fe2O3、Al2O3、Cu2O反应,Cu2O + 2H+ =" Cu" + Cu2++ H2O、Fe2O3+6H+="2" Fe3++3H2O、Al2O3+6H+="2" Al3++3H2O,而2Fe3++Cu=2Fe2++ Cu2+,可分析出滤液A中的离子一定有H+、Cu2+、Al3+,可能有Fe2+(铜较多)或Fe2+、Fe3+(铜较少)。再加入足量NaOH生成固体Cu(OH)2和铁的氢氧化物,空气中灼烧转化为F(Fe2O3、CuO的混合物),滤液C为偏铝酸钠和NaOH的混合液,可提取金属E(为Al的单质)。
(1)可能有Fe2+(Cu2O较多)或Fe2+、Fe3+(Cu2O较少)。
(2)铝热反应2Al+3CuO= Al2O3+3Cu。
(3)电解法进行粗铜精炼时a.SO2- 4向阳极移动,错误。b.粗铜接电源正极,发生氧化反应,做阳极,错误。c.精铜作阴极,由于阳极铜和杂质金属放电,阴极只有Cu2+放电,所以电解后电解液中Cu2+浓度减小,正确。d.当粗铜消耗6.4 g时,由于阳极铜和杂质金属放电,失去电子不一定为0.2NA个,错误。
考点:考查以工业流程为基础,考查元素及化合物性质、电解知识
本题难度:一般