微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备;其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2:向处理过的铁屑中加入过量的3 mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题
(1)在步骤1的操作中,下列仪器中不必用到的有_________(填仪器编号);
①铁架台②燃烧匙③锥形瓶④广口瓶⑤研钵⑥玻璃棒⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是____________________;
(3)在步骤3中,“一系列操作”依次为_______、_______和过滤;
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是_____________,可以观察到的现象是_______________。
参考答案:(1)②④⑤
(2)抑制亚铁离子的水解
(3
本题解析:
本题难度:一般
2、选择题 下列关于实验原理或操作的说法中, 不正确的是 [???? ]
A.检验Cl-、Br-、I-可以选用氯水、四氯化碳
B.将一小粒钠放入盛满水的烧杯中,观察钠与水的反应
C.用溴水可以鉴别SO2和CO2两种气体
D.制备乙酸乙酯时,将浓硫酸缓缓加入到乙醇和乙酸的混合液中
参考答案:B
本题解析:
本题难度:一般
3、简答题 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5-OH+HBr
浓H2SO4
△
C2H5Br+H2O
已知反应物的用量为:0.30mol?NaBr(s);0.25mol?C2H5OH(密度为0.80g-cm-3);36mL浓H2SO4(质量分数为98%,密度为1.84g-mL-1);25mL水.试回答下列问题.
(1)该实验应选择图中的a装置还是b装置?______.
(2)反应装置中的烧瓶应选择下列哪种规格最合适______
A.50mL???B.100mL????C.150mL????D.250mL
(3)冷凝管中的冷凝水的流向应是______
A.A进B出????????????B.B进A出?????????????C.从A进或B进均可
(4)可能发生的副反应为:______、______、______(至少写出3个方程式).
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是______.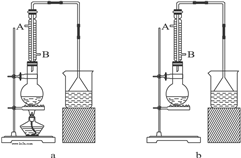
参考答案:(1)由题给信息,知该反应为:C2H5-OH+HBr
本题解析:
本题难度:一般
4、实验题 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯。
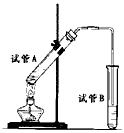
(1)写出制备乙酸乙酯的化学方程式___________________________。
(2)浓硫酸在实验中的作用是______________、______________。
(3)加热一段时间后,在试管B饱和碳酸钠溶液的液面上方有一 层油层,在油、水交界处观察到有气泡产生,气泡的主要成分是___________________。
(4)停止加热,取下试管B ,嗅闻管内液体气味,闻到更多的是刺激性气味,这是因为物质的挥发等因素导致产品混有杂质,如________和________等,为进一步验证产物中某些杂质存在,在保持试管B相对稳定情况下,沿试管内壁滴入紫色石蕊试液,静置片刻会在试管内油层下方明显看到液体呈现三种颜色
,由上而下分别为红色、紫色、蓝色,其原因可能是____________________________,故产品需进行提纯。
(5)已知乙醇能和氯化钙结合。将所得产品依次用饱和碳酸钠溶液、饱和食盐水、饱和氯化钙溶液洗涤油层,分别分液。用饱和食盐水洗涤去除油层中可能含有的______________杂质,减少乙酸乙酯的溶解,并防止对下面操作产生不利影响。
(6)在上述操作后,在所得油状液体中加入无水硫酸钠充分振荡,倾倒出油状液体,再进行__________(填提纯的操作方法),收集74~78℃的馏分即可获得较纯净的乙酸乙酯。
参考答案:(1)CH3COOH+CH3CH2OH![]()
本题解析:
本题难度:困难
5、简答题 “酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示装置制取乙酸乙酯.
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:______
(2)浓硫酸的作用是:①______;③______
(3)插入右边试管的导气管上接有一个球状容器,其作用为______
(4)将接收液与乙酸乙酯分离的方法是______
(5)做此实验时,有时还向作反应容器的试管里加入几块碎瓷片,其目的是______
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
②单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
③混合物中各物质的物质的量相等.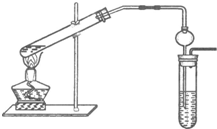
参考答案:(1)乙酸乙酯制取的反应方程式是:CH3COOH+CH3CH
本题解析:
本题难度:一般