微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 超氧化钾(KO2)是一种金黄色固体粉末。超氧化钾又称为“化学氧自救器”,主要用于煤矿井下急救。它能够和人呼出的二氧化碳接触产生氧气,可作为氧气源用于呼吸面罩,可作为飞船、潜艇等密闭系统的氧气再生剂。超氧化钾遇易燃物、有机物、还原剂等能引起燃烧爆炸,遇水或水蒸气产生大量热量,可能发生爆炸。某实验小组采用下列装置,用超氧化钾作原料制备并收集氧气。

请回答下列问题:
(1)请选取必要的装置,按照气流的方向,连接顺序为c_____j(填仪器接口的字母序号)。装置戊的作用是____。
(2)有同学用饱和Na2CO3溶液取代了装置丁中的饱和NaHCO3溶液,请你评价该同学的操作是否合理,并简要说明理由:____。
(3)装置甲中反应的化学方程式为___,装置甲中反应完全的标志有___ 。
(4)请设计实验探究实验后装置甲中残留物质是否含有过氧化钾或超氧化钾:___。
2、实验题 下图是实验室制取乙酸乙酯的装置。
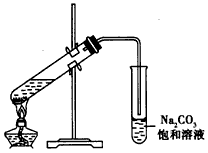
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法:将_____________________,并轻轻地振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸,造成倒吸的原因是________________________。
(3)浓硫酸的作用是:①________________________;②________________________。
(4)饱和N2CO3溶液的作用是____________________________。
(5)实验中生成的乙酸乙酯,其密度比水_______(填“大” 或“小”),有_______气味。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物有________________(填物质名称)。
3、实验题 为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化 铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。

请回答:
(1)步骤I、Ⅱ、Ⅲ中均需进行的实验操作是________________。
(2)溶液A中的离子主要有_________;试剂X是___________。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到 烧杯中产生的白色沉淀逐渐减少,其原因是_______________________(用离子方程式表示);为了避免固体C减少,根据下图所示,改进的措施是______________________。

(4)从环境保护角度考虑,用固体F制备CuSO4溶液的化学方程式是______________________。
4、实验题 锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下
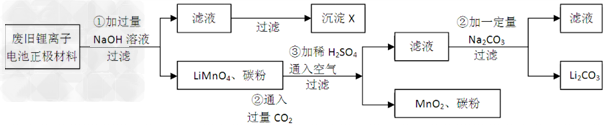
(1)第②步反应得到的沉淀X的化学式为_____________。
(2)第③步反应的离子方程式是______________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_________?。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因________、__________。
5、实验题 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用其产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。

(1)装置B中发生反应的化学方程式为____ 。
(2)装置E中的现象是____ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,将滤液分成两份,分别检验滤液中的金属阳离子。检验Fe3+所用的试剂为___ 检验Fe2+所用的试剂为___。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下
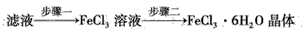
①步骤一中通入足量Cl2发生反应的离子方程式为___。
②步骤二从FeCl3溶液中得到FeCl3·6H2O晶体的主要操作如下(均在HCl气氛中进行): 蒸发、浓缩→冷却、结晶→过滤、洗涤、干燥 在蒸发皿中进行蒸发、浓缩操作时,当____时,应停止加热。此过程应保持盐酸过量的原因是___(用离子方程式表示)。
(5) FeCl3溶液可用于天然气脱硫,写出FeCl3溶液与天然气中的H2S反应的离子方程式:____。