微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为
[Al2(OH)nClm·yH2O]x,式中m等于[???? ]
A.3-n
B.6-n
C.6+n
D.3+n
参考答案:B
本题解析:
本题难度:简单
2、填空题 【物质结构与性质】(8分)
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛。
(1)铜原子的核外电子排布式是????????????????????;O、N、S的第一电离能由大到小的顺序为????????????????????。
(2)铜的熔点比钙高,其原因是?????????????????????????;
右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为????????????????。

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有???????????????(填序号)。
A.配位键B.金属键C.极性共价键D.非极性共价键E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为???????????(填序号)。
A.平面正方形?????? B.正四面体???? C.三角锥型???? D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为???????????。
参考答案:(1)1s22s22p63s23p63d104s1 (1分)
本题解析:
(1)铜原子的核外电子排布式是1s22s22p63s23p63d104s1,O、N、S的第一电离能由大到小的顺序为N>O>S,N原子的2P3为半充满结构,较稳定,第一电离能大于同周期的氧原子。
(2)铜的熔点比钙高,铜钙是金属晶体,说明铜的金属键强于钙;钙原子:8×1/8=1,铜:
8×1/2+1=5。
(3)①[Cu(NH3)4]2+中存在的化学键类型:Cu2+ 与NH3分子之间配位键,NH3中N―H键极性共价键,故选AC。
②如果是正四面体,两个NH3被两个Cl-取代后
本题难度:一般
3、填空题 Ⅰ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的价电子(外围电子)排布式为 ???????????????。?
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。?
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2 CH2、②HC≡CH、③
CH2、②HC≡CH、③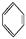 、④HCHO,来源:www.91exam.org其中碳原子采取sp2杂化的分子有???????(填物质序号),HCHO分子的立体结构为 形。?
、④HCHO,来源:www.91exam.org其中碳原子采取sp2杂化的分子有???????(填物质序号),HCHO分子的立体结构为 形。?
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。?
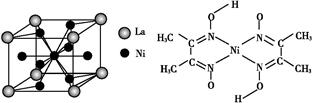
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。?
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
参考答案:(1)3d84s2
(2)N2 CN-(或O22—、C
本题解析:(1)根据构造原理可知,基态镍原子的价电子(外围电子)排布式为3d84s2。
(2)价电子数与原子数分别都相等的是等电子体,因此与CO互为等电子体的一种分子和一种离子的化学式分别是N2和CN-。
(3)乙烯、苯、甲醛都是平面形结构,因此碳原子都是sp2杂化。乙炔是直线形结构,所以碳原子是sp杂化,因此答案选①③④。甲醛分子中中心碳原子没有孤对电子,因此甲醛是平面三角形结构。
(4)NiO与FeO形成的晶体都是离子晶体,构成离子晶体的离子半径越小,电荷数越多,离子键越强,晶格能越大,熔点就
本题难度:一般
4、选择题 下列物质中含有非极性键的分子是( )
A.Na2O2
B.CH4
C.N2
D.CO2
参考答案:C
本题解析:
本题难度:一般
5、选择题 有关化学用语正确的是[???? ]
A.乙炔的最简式C2H2
B.NH3、H2O、CO2、HCl分子中CO2孤电子对最多
C.水的电子式 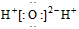
D.硝酸钾的化学式 KNO3
参考答案:D
本题解析:
本题难度:简单