微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质不能使溴水层褪色的是
A.镁粉
B.苯
C.苯乙烯
D.碘化钾
参考答案:D
本题解析:镁与溴水反应得到溴化镁无色溶液,苯可以发生萃取使水层无色,苯乙烯可以和溴水发生加成反应,得到无色溶液.而碘化钾与溴水发生置换反应以后,得到的碘水也有颜色.
本题难度:一般
2、选择题 充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等。则X的分子式是(相对原子质量:H:1,C:12,O:16)( )
A.C10H16
B.C11H14
C.C12H18
D.C13H20
参考答案:C
本题解析:试题分析:烃燃烧后,其中的H全部转入水中,故水中氧元素的质量等于烃中碳的质量。芳香烃中: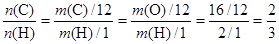 ,所以答案选C。
,所以答案选C。
考点:考查有机物燃烧的有关计算
点评:该题是中等难度的试题,也是高考中的常见考点。试题基础性强,注重解题方法的指导和培养,有利于培养学生的逻辑推理能力,和发散思维能力。该题的关键是得出水中氧元素的质量等于烃中碳的质量,然后结合题意灵活运用即可,有助于培养学生的应试能力,提高学习效率。
本题难度:困难
3、选择题 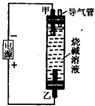 利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是
利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是
A.只能用铁作甲电极和乙电极
B.甲电极上有氢气逸出
C.烧碱溶液注入容器前,需先煮沸
D.可用食盐水代替烧碱溶液
参考答案:A
本题解析:分析:A.阳极应该用铁电极,阴极用惰性电极亦可;
B.甲为阴极,是溶液中的阳离子氢离子放电;
C.氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁;
D.电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
解答:电解法制备Fe(OH)2 时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其它能导电的材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe(OH)2沉淀,
A.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故A错误;
B.甲为阴极,是溶液中的阳离子氢离子放电,方程式为:2H++2e-=H2↑,故B正确;
C.氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以,烧碱溶液注入容器前,需先煮沸除尽氧气,故C正确;
D.电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会再阳极失电子,所以选用NaCl溶液不影响实验,故D正确;
故选A.
点评:本题主要考查了氢氧化亚铁沉淀的制备,掌握电解池的原理及其应用是解答的关键,题目难度不大.
本题难度:困难
4、选择题 24mLH2S在30mLO2中燃烧,在同温同压下,得到SO2的体积为
A.24mL
B.30mL
C.20mL
D.18mL
参考答案:D
本题解析:H2S燃烧的化学方程式:
2H2S+O2(不足) 2S↓+2H2O?????????①
2S↓+2H2O?????????①
当O2过量时,继续发生化学反应
S+O2  ?SO2?????????????????????????????????????????????????②
?SO2?????????????????????????????????????????????????②
合并得
2H2S+3O2 ![]() ?2SO2+2H2O③
?2SO2+2H2O③
则当V(H2S)∶V(O2)≥2∶1时,只按①式进行。
当V(H2S)∶V(O2)≤2∶3时,只按③式进行。
当2∶3<V(H2S)∶V(O2)<2∶1时,可按①式和②式进行(如按①式和③式进行)。
解法一:2H2S+O2  ?2S↓+2H2O①
?2S↓+2H2O①
2H2S+3O2 ![]() ?2SO2+2H2O②
?2SO2+2H2O②
从①式考虑:2H2S?~? O2?~? 2S
24mL??????????? 30mL
可知余O2为:30mL-12mL=18mL
余O2会继续与S反应生成SO2,由此可确定生成SO2的体积:
O2?~? SO2
18mL? 18mL
答案为D。
从②式考虑:2H2S?~? 3O2?~? 2SO2
20mL??? 30mL??? 20mL
余H2S的体积:24mL-20mL=4mL
因2H2S+SO2![]() ?2H2O+3S↓
?2H2O+3S↓
4mLH2S将消耗2mLSO2,剩余SO2为20mL-2mL=18mL。
解法二:H2S在O2中燃烧,按H2S与O2的体积比(或物质的量之比)不同,可发生不同的反应。
当V(H2S)∶V(O2)≥2∶1时:只发生2H2S+O2 ?2S↓+2H2O
?2S↓+2H2O
当V(H2S)∶V(O2)≤2∶3时:只发生2H2S+3O2 ?2SO2+2H2O
?2SO2+2H2O
现V(H2S)∶V(O2)=24∶30=4∶5,介于2∶1~2∶3之间,所以两个反应均发生。
设不完全燃烧H2S的体积为x,完全燃烧H2S的体积为y,则
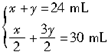 ????解得???
????解得???
由化学方程式知:生成SO2的体积等于完全燃烧的H2S的体积,即为18mL。
解法三:本题H2S与O2的体积之比为2∶1>V(H2S)∶V(O2)>2∶3,说明两种燃烧方式均存在,可根据题给H2S与O2的体积(或物质的量)之比写出总的反应方程式:
xH2S+yO2 ![]() ?xH2O+
?xH2O+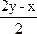 SO2+
SO2+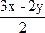 S
S
将x=24mL、y=30mL代入![]() ,
,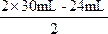 =18mL。
=18mL。
本题难度:困难
5、选择题 向明矾[KAl(SO4)2]溶液中滴入氢氧化钡溶液,当硫酸根离子恰好完全沉淀时,铝元素的存在形式是
A.一部分为Al(OH)3,一部分为Al3+
B.一部分为Al(OH)3,一部分为Al(OH)4-
C.全部是Al(OH)3
D.全部为Al(OH)4-
参考答案:D
本题解析:分析:向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,发生KAl(SO4)2+2Ba(OH)2═2BaSO4↓+KAlO2+2H2O,以此来解答.
解答:向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,
1molKAl(SO4)2需要消耗2molBa(OH)2,
则发生KAl(SO4)2+2Ba(OH)2═2BaSO4↓+KAl(OH)4,
显然铝元素几乎全部以Al(OH)4-形式存在于溶液中,
故选D.
点评:本题考查离子反应,明确硫酸根离子完全沉淀时消耗的氢氧化钡的量是解答本题的关键,题目难度不大.
本题难度:简单