微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 用铜片、锌片和200mL稀H2SO4等组成原电池(如图)。若整个实验过程有6.5 g锌溶解,此时H2SO4恰好全部用完。回答下列问题:
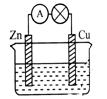
(1)写出正极的电极反应式 ,正极发生的现象是 ,负极的电极反应式为  。
。
(2)试计算:铜片上共放出 L气体(标准状况),整个实验过程转移电子 mol,稀硫酸的物质的量浓度为 mol/L。
2、选择题 一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气。电极反应式为:C2H6 +180H- -14e-="=" 2C032一+ 12H20;??? 7H20+7/2 02+14e - ="=140H" -.
下列有关此电池的推断错误的是??????????????????????????????????????????????????????????????????????????(???)
A.在电解质溶液中OH -向正极移动
B.参加反应的02与C2H6的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.通氧气的电极为正极
3、填空题 将锌片和铜片插入某种电解质溶液中,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是________极(填“锌”或“铜”),铜极发生的反应
____________,是____________,该电池的总反应方程式是____________________。
(2)若电解质溶液是硫酸铜溶液,在导线中电子是由_____极流向______极,铜极上的电极反应方程式是
____________________,该电池总反应方程式是____________________。
4、填空题 雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为____________。
(2)上述反应中的氧化剂是________?,反应产生的气体可用_________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+?3S+10NO2↑+?2H2O 若生成2mol?H3AsO4,则反应中转移电子的物质的量为____________。若将该反应设计成一原电池,则NO2应该在_____________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L?O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量________(选填编号)。
a.小于0.5?mol????b.等于0.5?mol????c.大于0.5mol????d.无法确定
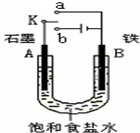
5、填空题 某课外活动小组同学用右图装置进行实验,试回答下列问题.
(1)若开始时开关K与a连接,则B极的电极反应式为______.
(2)若开始时开关K与b连接,则B极的电极反应式为______,总反应的离子方程式为______,有关该实验的下列说法正确的是(填序号)______.
①溶液中Na+向A极移动?????②从A极处逸出的气体能使湿润KI淀粉试纸变蓝???③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度???④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用右图装置电解硫酸钾溶液来制取氢
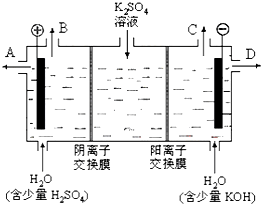
气、氧气、硫酸和氢氧化钾.
①该电解槽的阳极反应式为______.此时通过阴离子交换膜的离子数______(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从(填写“A”、“B”、“C”、“D”)______出口导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因______.
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为______.