微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
D.单位时间内,消耗2molH2的同时消耗1mol CH3OH
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是 ;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K(写出计算过程)。

(2)已知: CO(g)+  O2(g)=CO2(g)?△H2=-283 kJ·mol-1?H2(g)+
O2(g)=CO2(g)?△H2=-283 kJ·mol-1?H2(g)+  O2(g)=H2O(g)?△H3=-242 kJ·mol-1
O2(g)=H2O(g)?△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________
参考答案:(1)①AD(2分,漏选得1分,错选得0分)
②270
本题解析:
试题分析:(1)①A选项因反应前后气体的量发生改变,压强不变,可以说明到达平衡。D选项满足V正=V逆②因为Z图像中CO的转化率最低,所以对应的温度最高。270℃?。根据图像可知a点对应的CO的转化率为50%,H2的物质的量为1.5 mol
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始物质的量浓度(mol/L) 1 1.5 0
转化物质的量浓度(mol/L) 0.5 1 0.5
平衡物质的量浓度(mol/L) 0.5 0.5 0.5
K=4?
(2)利用盖斯定律可以写出CH3OH(g)+3/2O2(g) CO2(g)+2H2O(g) △H=—△H1+△H2+2△H3
CO2(g)+2H2O(g) △H=—△H1+△H2+2△H3
本题难度:一般
2、选择题 在密闭容中发生下列反应aA(g)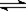 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 (???? )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 (???? )
A.A的转化率变大
B.平衡向正反应方向移动
C.D的体积分数变大
D.a < c+d
参考答案:D
本题解析:将气体体积压缩到原来的一半瞬间D的浓度是用来的2倍,但达到平衡时,D的浓度为原平衡的1.8倍,说明增大压强平衡向逆反应方向移动,因此a < c+d,所以正确的答案选D。
本题难度:简单
3、选择题 在不同情况下测得A(g)+3B(g)?2C(g)+2D(g)的下列反应速率,其中反应速率最大的是( )
A.υ(D)=0.4mol?L-1?s-1
B.υ(C)=0.5mol?L-1?s-1
C.υ(B)=0.6mol?L-1?s-1
D.υ(A)=2mol?L-1?min-1
参考答案:反应速率与化学计量数的比值越大,反应速率越快,
A.<
本题解析:
本题难度:一般
4、选择题 在一定条件下,将3mol?A和1mol?B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol?D,并测得C的浓度为0.2mol?L-1.下列判断正确的是( )
A.A的转化率为40%
B.2?min内B的反应速率?为0.2?mol?(L?min)-1
C.x=2
D.若混合气体的密度不变,则表明该反应已达到平衡状态
参考答案:A、2min末该反应达到平衡,生成0.8mol?D,由方程式
本题解析:
本题难度:简单
5、选择题 在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g);已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡后HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.3mol·L-1,则平衡时H2的浓度是[???? ]
2HI(g);已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡后HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.3mol·L-1,则平衡时H2的浓度是[???? ]
A.0.16mol·L-1
B.0.06mol·L-1
C.0.04mol·L-1
D.0.08mol·L-1
参考答案:B
本题解析:
本题难度:一般